Lithiumhydrid ist eine Verbindung aus Lithium und Wasserstoff. Es ist hochreaktiv und wird häufig in verschiedenen Anwendungen eingesetzt, einschließlich Energiespeicherung und Kernreaktionen.
| IUPAC-Name | Lithiumhydrid |
| Molekularformel | LiH |
| CAS-Nummer | 7580-67-8 |
| Synonyme | Lithiummonohydrid, Lithan, Lithiumhydrid, Lithiumhydrid |
| InChI | InChI=1S/Li.H |
Eigenschaften von Lithiumhydrid
Lithiumhydrid-Formel
Die Formel für Lithiummonohydrid lautet LiH. Es besteht aus einem Lithiumatom, das an ein Wasserstoffatom gebunden ist. Diese einfache und prägnante Formel stellt die elementare Zusammensetzung von Lithiummonohydrid dar.
Molmasse von Lithiumhydrid
Die Molmasse von Lithiummonohydrid wird durch Addition der Atommassen von Lithium (Li) und Wasserstoff (H) berechnet. Das sind ungefähr 7,95 Gramm pro Mol (g/mol). Die Molmasse ist für verschiedene Berechnungen in der Chemie von entscheidender Bedeutung, beispielsweise für die Bestimmung der Stoffmenge in einer bestimmten Probe.
Siedepunkt von Lithiumhydrid
Lithiummonohydrid hat einen hohen Siedepunkt von etwa 1.350 Grad Celsius (2.462 Grad Fahrenheit). Dies weist darauf hin, dass eine erhebliche Energiemenge erforderlich ist, um die feste Verbindung in den gasförmigen Zustand umzuwandeln.
Schmelzpunkt von Lithiumhydrid
Der Schmelzpunkt von Lithiummonohydrid ist mit etwa 688 Grad Celsius (1.270 Grad Fahrenheit) recht hoch. Diese Temperatur stellt den Punkt dar, an dem die feste Verbindung beim Erhitzen in einen flüssigen Zustand übergeht.
Dichte von Lithiumhydrid g/ml
Die Dichte von Lithiummonohydrid beträgt etwa 0,82 Gramm pro Milliliter (g/ml). Dieser Wert weist darauf hin, dass Lithiummonohydrid eine relativ dichte Verbindung ist, also eine große Masse pro Volumeneinheit aufweist.
Molekulargewicht von Lithiumhydrid
Das Molekulargewicht von Lithiummonohydrid wird durch Addition der Atomgewichte von Lithium und Wasserstoff bestimmt. Das sind ungefähr 7,95 Gramm pro Mol (g/mol). Das Molekulargewicht ist bei verschiedenen chemischen Berechnungen von entscheidender Bedeutung, insbesondere bei der Bestimmung der Stöchiometrie von Reaktionen.
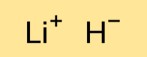
Lithiumhydrid-Struktur
Lithiummonohydrid hat eine Kristallstruktur, in der Lithiumkationen (Li+) und Hydridanionen (H-) in einem dreidimensionalen Gitter angeordnet sind. Lithium- und Wasserstoffatome werden durch starke Ionenbindungen zusammengehalten.
Löslichkeit von Lithiumhydrid
Lithiummonohydrid ist in Wasser schlecht löslich. Es reagiert mit Wasser unter Bildung von Lithiumhydroxid (LiOH) und Wasserstoffgas (H2). Diese begrenzte Löslichkeit ist auf die stark ionische Natur von Lithiummonohydrid zurückzuführen, wodurch es weniger wahrscheinlich ist, dass es sich in polaren Lösungsmitteln wie Wasser auflöst.
| Aussehen | Weißer Feststoff |
| Spezifisches Gewicht | 0,82 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 7,95 g/Mol |
| Dichte | 0,82 g/ml |
| Fusionspunkt | 688 °C (1270 °F) |
| Siedepunkt | 1350 °C (2462 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert mit Wasser unter Bildung von Lithiumhydroxid (LiOH) und Wasserstoffgas (H2). |
| Löslichkeit | Schwer löslich |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Lithiumhydrid
Lithiummonohydrid birgt mehrere Sicherheitsrisiken. Es reagiert heftig mit Wasser, setzt brennbares Wasserstoffgas frei und erzeugt ätzendes Lithiumhydroxid. Bei Kontakt mit Feuchtigkeit oder Luft kann sich leicht entzündliches Wasserstoffgas bilden. Es muss mit äußerster Vorsicht gehandhabt werden, um eine versehentliche Entzündung oder Explosion zu vermeiden. Die Verbindung reagiert auch sehr reaktiv mit Säuren und setzt giftiges Wasserstoffgas frei. Lithiummonohydrid kann schwere Reizungen der Haut und der Augen verursachen und das Einatmen von Staub oder Dämpfen kann zu Atembeschwerden führen. Bei der Arbeit mit Lithiummonohydrid sollte geeignete Schutzausrüstung wie Handschuhe und Schutzbrille getragen und an einem trockenen, gut belüfteten Ort gelagert werden.
| Gefahrensymbole | Entzündlich, ätzend |
| Sicherheitsbeschreibung | Sehr reaktiv und brennbar. Mit äußerster Vorsicht umgehen. Kontakt mit Wasser, Luft und Säuren vermeiden. |
| UN-Identifikationsnummern | UN 1414 |
| HS-Code | 2850.00.10 |
| Gefahrenklasse | 4.3 (Gefährlich bei Nässe) |
| Verpackungsgruppe | Ich (große Gefahr) |
| Toxizität | Giftig beim Verschlucken oder Einatmen. Kann schwere Haut- und Augenreizungen verursachen. |
Methoden zur Lithiumhydrid-Synthese
Zur Synthese von Lithiummonohydrid können verschiedene Methoden eingesetzt werden.
Eine gängige Methode ist die direkte Kombination von metallischem Lithium mit Wasserstoffgas. Die Reaktion findet bei hohen Temperaturen, typischerweise über 600 Grad Celsius (1.112 Grad Fahrenheit), in einer kontrollierten Umgebung statt. Lithiummetall reagiert mit Wasserstoffgas unter Bildung von Lithiummonohydrid.
Eine weitere Methode ist die Reduktion von Lithiumamid (LiNH2) mit Lithiummetall. Diese Reaktion findet bei niedrigeren Temperaturen statt, etwa 350 bis 400 Grad Celsius (662 bis 752 Grad Fahrenheit). Bei der Reaktion von Lithiumamid mit Lithiummetall entsteht Lithiummonohydrid.
Die Synthese von Lithiummonohydrid kann auch durch die Kombination von Lithiumborhydrid (LiBH4) mit Lithiummonohydrid selbst erfolgen. Die Reaktion findet bei hohen Temperaturen statt, normalerweise um die 400 Grad Celsius (752 Grad Fahrenheit). Dieses Verfahren ermöglicht die Bildung von Lithiummonohydrid aus leicht verfügbarem Lithiumborhydrid.
Darüber hinaus dient Lithiumaluminiumhydrid (LiAlH4) als Rohstoff für die Synthese von Lithiummonohydrid. Unter kontrollierten Bedingungen reagiert Lithiumaluminiumhydrid mit Lithiummetall, was zur Bildung von Lithiummonohydrid führt.
Es ist zu beachten, dass diese Methoden aufgrund der hochreaktiven Natur von Lithiummonohydrid eine sorgfältige Handhabung und eine strenge Kontrolle der Reaktionsbedingungen erfordern. Während des Syntheseprozesses sollten Sicherheitsvorkehrungen wie das Arbeiten in einer inerten Atmosphäre und die Verwendung geeigneter Schutzausrüstung befolgt werden.
Verwendung von Lithiumhydrid
Aufgrund seiner einzigartigen Eigenschaften und Reaktivität findet Lithiummonohydrid vielfältige Anwendungen. Hier sind einige seiner Verwendungsmöglichkeiten:
- Lithiummonohydrid ermöglicht die Entwicklung fortschrittlicher Wasserstoffspeichersysteme und ermöglicht effiziente und kompakte Energiespeicherlösungen.
- Bei Kernreaktionen fungiert es als Neutronenquelle und findet Anwendung in Forschungseinrichtungen und Kernkraftwerken.
- Die organische Synthese nutzt Lithiummonohydrid als starkes Reduktionsmittel zur Reduktion verschiedener funktioneller Gruppen.
- Durch die Reaktion mit Wasser oder Säuren entsteht Wasserstoffgas, was es für die Wasserstoffproduktion vor Ort wertvoll macht.
- In Kombination mit anderen Treibstoffen trägt Lithiummonohydrid zur Stromerzeugung und zum Schub von Raketentriebwerken bei.
- Lithiummonohydrid spielt eine Rolle bei der Produktion von Deuteriumgas, das in der Kernenergieerzeugung und in der wissenschaftlichen Forschung Anwendung findet.
- Hydrometallurgische Verfahren nutzen Lithiummonohydrid zur Herstellung verschiedener Metalle wie Titan und Zirkonium.
- Es dient als Vorläufer oder Reagens in der chemischen Synthese und trägt zur Bildung organischer und anorganischer Verbindungen bei.
- Einige pyrotechnische Formulierungen verwenden Lithiummonohydrid, um während der Reaktion starke Hitze und Gase zu erzeugen.
- Hydrierungsreaktionen nutzen Lithiummonohydrid, um Wasserstoff an ungesättigte Verbindungen zu addieren und so gesättigte Verbindungen zu bilden.
Diese vielfältigen Anwendungen unterstreichen die Vielseitigkeit und Bedeutung von Lithiummonohydrid in zahlreichen Branchen und wissenschaftlichen Bestrebungen.
Fragen:
F: Wie lautet die Formel für das von Lithium gebildete Hydrid?
A: Die Formel für das von Lithium gebildete Monohydrid lautet LiH.
F: Reduziert Lithiumhydrid Doppelbindungen?
A: Ja, Lithiummonohydrid kann Doppelbindungen in organischen Verbindungen reduzieren.
F: Was reduziert Lithiumhydrid?
A: LiH ist ein starkes Reduktionsmittel, das üblicherweise zur Reduktion verschiedener funktioneller Gruppen in der organischen Synthese verwendet wird.
F: Ist Lithiumhydrid ionisch oder kovalent?
A: Lithiummonohydrid ist eine ionische Verbindung, die aus Li+-Kationen und H–Anionen besteht.
F: Was ist der Unterschied zwischen Lithium-Ionen-Batterien und Nickel-Metallhydrid-Batterien?
A: Li-Ionen-Batterien bieten eine höhere Energiedichte, eine längere Lebensdauer und ein geringeres Gewicht als Nickel-Metallhydrid-Batterien.
F: Was ist der Mechanismus von Lithiumhydrid?
A: Der Mechanismus von Lithiummonohydrid variiert je nach seiner spezifischen Reaktion und Anwendung. Es kann als Reduktionsmittel wirken oder mit Wasser, Säuren oder anderen Verbindungen reagieren.
F: Ist Lithiumhydrid ein Nukleophil?
A: Ja, Lithiummonohydrid kann bei bestimmten chemischen Reaktionen als Nukleophil wirken.
F: Welche Gegenstände entstehen durch Lithiumhydrid?
A: Lithiummonohydrid wird hauptsächlich in industriellen Anwendungen wie Energiespeichersystemen, Kernreaktionen, Wasserstoffproduktion und chemischen Synthesen verwendet.
F: Reduziert Lithiumhydrid Alkohole?
A: Lithiummonohydrid kann Alkohole abhängig von den Reaktionsbedingungen und anderen Faktoren zu den entsprechenden Alkanen oder Aldehyden reduzieren.
