Lithiumcarbonat (Li2CO3) ist eine essentielle Verbindung, die in stimmungsstabilisierenden Medikamenten verwendet wird. Es behandelt bipolare Störungen und hilft bei der wirksamen Bewältigung von Depressionen, wodurch das allgemeine psychische Wohlbefinden gefördert wird.
| IUPAC-Name | Lithiumcarbonat |
| Molekularformel | Li2CO3 |
| CAS-Nummer | 554-13-2 |
| Synonyme | Dilithiumcarbonat; Kohlensäure, Dilithiumsalz; Lithiumcarbonat(1+); Kohlensäure, Lithiumsalz (1:1) |
| InChI | InChI=1S/CH2O3.2Li/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2 |
Eigenschaften von Lithiumcarbonat
Lithiumcarbonat-Formel
Die Formel für Dilithiumcarbonat lautet Li2CO3. Das bedeutet, dass jedes Molekül zwei Lithiumatome (Li), ein Kohlenstoffatom (C) und drei Sauerstoffatome (O) enthält. Diese chemische Zusammensetzung spielt eine entscheidende Rolle für seine Eigenschaften und Anwendungen.
Molmasse von Lithiumcarbonat
Die Molmasse von Dilithiumcarbonat beträgt etwa 73,89 g/mol. Sie wird durch Addition der Atommassen der einzelnen Elemente unter Berücksichtigung ihrer jeweiligen Anteile in der Formel berechnet. Dieser Wert ist für verschiedene chemische Berechnungen und Reaktionen mit Dilithiumcarbonat von wesentlicher Bedeutung.
Siedepunkt von Lithiumcarbonat
Dilithiumcarbonat hat einen hohen Siedepunkt, typischerweise etwa 1.310 Grad Celsius (2.390 Grad Fahrenheit). Bei dieser Temperatur wandelt sich die Verbindung von flüssig in gasförmig um und ist somit für bestimmte industrielle Prozesse und Anwendungen geeignet.
Schmelzpunkt von Lithiumcarbonat
Dilithiumcarbonat hat einen relativ niedrigen Schmelzpunkt, typischerweise etwa 720 Grad Celsius (1.328 Grad Fahrenheit). Bei dieser Temperatur wandelt sich die Verbindung von einem Feststoff in eine Flüssigkeit um, was ihre Verwendung bei der Herstellung von Keramik, Glas und anderen Materialien erleichtert.
Dichte von Lithiumcarbonat g/ml
Die Dichte von Dilithiumcarbonat beträgt etwa 2,11 g/ml. Dieser Wert stellt die Masse pro Volumeneinheit dar und gibt an, wie dicht die Partikel zusammengepackt sind. Die Dichte von Dilithiumcarbonat ist entscheidend für das Verständnis seiner physikalischen Eigenschaften und seines Verhaltens.
Molekulargewicht von Lithiumcarbonat
Dilithiumcarbonat hat ein Molekulargewicht von etwa 73,89 g/mol. Dieser Wert entspricht der Masse eines Mols der Verbindung und ist für verschiedene chemische Berechnungen von wesentlicher Bedeutung, beispielsweise für die Bestimmung der Molzahl einer bestimmten Substanzmenge.
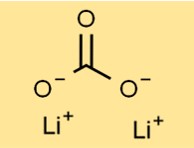
Struktur von Lithiumcarbonat
Dilithiumcarbonat hat eine kristalline Struktur und bildet ein weißes, geruchloses Pulver. Seine Anordnung besteht aus Li+-Kationen und Carbonatanionen (CO3^2-), die durch ionische Bindungen zusammengehalten werden. Diese spezielle Anordnung trägt zur Stabilität und Reaktivität der Verbindung bei.
Löslichkeit von Lithiumcarbonat
Dilithiumcarbonat ist in Wasser nur begrenzt löslich. Es löst sich teilweise auf und bildet eine leicht alkalische Lösung. Die Löslichkeit von Dilithiumcarbonat ist ein entscheidender Aspekt bei pharmazeutischen Formulierungen und anderen Anwendungen, bei denen eine kontrollierte Auflösung erforderlich ist.
| Aussehen | Weißes, geruchloses Pulver |
| Spezifisches Gewicht | 2,11 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 73,89 g/Mol |
| Dichte | 2,11 g/ml |
| Fusionspunkt | 720 °C (1328 °F) |
| Siedepunkt | 1310 °C (2390 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Begrenzte Löslichkeit |
| Löslichkeit | In Wasser löslich, bildet eine leicht alkalische Lösung |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Leicht alkalisch |
Sicherheit und Gefahren von Lithiumcarbonat
Dilithiumcarbonat birgt potenzielle Sicherheitsrisiken, die eine sorgfältige Handhabung erfordern. Direkter Hautkontakt kann zu Reizungen führen, während die Einnahme zu Magen-Darm-Beschwerden führen kann. Bei übermäßiger Exposition kann es schädliche Auswirkungen auf das Nervensystem haben. Bei der Handhabung sollten angemessene Sicherheitsvorkehrungen getroffen werden, wie z. B. das Tragen von Schutzausrüstung, um mögliche Gefahren zu vermeiden. Es ist von entscheidender Bedeutung, Dilithiumcarbonat fern von inkompatiblen Substanzen und Wärme- oder Flammenquellen zu lagern und zu transportieren. Suchen Sie in Notsituationen sofort einen Arzt auf. Bei der Arbeit mit Dilithiumcarbonat sollten Sicherheitsdatenblätter und Richtlinien sorgfältig gelesen und befolgt werden.
| Gefahrensymbole | Ätzend, Reizend |
| Sicherheitsbeschreibung | Kann Reizungen verursachen. Vermeiden Sie die Einnahme. Bei ausreichender Belüftung verwenden. Schutzausrüstung tragen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 2836.40.00 |
| Gefahrenklasse | Nicht als gefährlich eingestuft |
| Verpackungsgruppe | Nicht klassifiziert |
| Toxizität | Geringe Toxizität |
Methoden zur Lithiumcarbonat-Synthese
Es gibt verschiedene Methoden zur Synthese von Dilithiumcarbonat.
Ein gängiger Ansatz besteht darin, Lithiumverbindungen wie Lithiumhydroxid oder Lithiumoxid unter kontrollierten Bedingungen Kohlendioxid auszusetzen. Bei der Reaktion entstehen als Nebenprodukt Lithiumcarbonat und Wasser. Eine andere Methode besteht darin, lösliche Lithiumsalze wie Lithiumchlorid mit einer löslichen Carbonatverbindung zu mischen. Bei der Reaktion entsteht ein fester Niederschlag aus Lithiumcarbonat, den Forscher abtrennen und sammeln können.
Darüber hinaus ist es möglich, Dilithiumcarbonat durch thermische Zersetzung von Lithiumbicarbonat herzustellen. Beim Erhitzen zerfällt Lithiumbicarbonat zu Lithiumcarbonat und setzt dabei Kohlendioxid und Wasser frei. Einige Industriebetriebe nutzen dieses Verfahren, um hochreines Lithiumcarbonat zu erhalten.
Um die gewünschten Ausbeuten und Reinheitsgrade zu erreichen, müssen sie unabhängig von der verwendeten Methode eine angemessene Kontrolle der Reaktionsparameter wie Temperatur, Druck und Stöchiometrie gewährleisten. Die Synthese von Dilithiumcarbonat spielt eine entscheidende Rolle bei der Herstellung dieser Verbindung für verschiedene Anwendungen, darunter Pharmazeutika, Keramik und Batterien.
Verwendungsmöglichkeiten von Lithiumcarbonat
Dilithiumcarbonat findet aufgrund seiner einzigartigen Eigenschaften vielfältige Anwendungen. Hier sind seine Hauptverwendungen:
- Pharmazeutika: Es ist ein wesentlicher Bestandteil stimmungsstabilisierender Medikamente, behandelt wirksam bipolare Störungen und Depressionen und fördert das psychische Wohlbefinden.
- Batterien: In wiederaufladbaren Lithium-Ionen-Batterien dient Dilithiumcarbonat als Vorstufe für Lithiumverbindungen und spielt eine entscheidende Rolle in Energiespeichertechnologien.
- Pyrotechnik: Die exotherme Reaktion von Dilithiumcarbonat mit bestimmten Chemikalien macht es für Feuerwerkskörper und Fackeln wertvoll.
- Chemische Synthese: Als Quelle für Lithiumionen ist es für verschiedene chemische Reaktionen und organische Synthesen unerlässlich.
- Quelle von Alkalimetallen: Es dient als Lithiumquelle in Labors und Forschung und wird zur Untersuchung der Eigenschaften von Alkalimetallen verwendet.
- Umweltanwendungen: Dilithiumcarbonat hilft bei der Regulierung des pH-Werts in Wasseraufbereitungsprozessen und kontrolliert den Säuregehalt und die Alkalität.
- Keramik und Glas: Dilithiumcarbonat verbessert die Stabilität von Keramik- und Glasprodukten, indem es als Flussmittel dient und dadurch die Schmelztemperaturen senkt.
- Metallurgie: In der Metallurgie veredelt Dilithiumcarbonat Metalle wie Aluminium und Kupfer, entfernt effektiv Verunreinigungen und verbessert ihre mechanischen Eigenschaften.
- Klimaanlage: Trockenmittel in Klimaanlagen nutzen Dilithiumcarbonat, um Feuchtigkeit effektiv zu absorbieren und so eine optimale Klimatisierungsleistung zu gewährleisten.
Insgesamt unterstreicht das breite Anwendungsspektrum von Dilithiumcarbonat seine branchenübergreifende Bedeutung und macht es zu einer wertvollen Verbindung in der modernen Technologie, Medizin und Materialwissenschaft.
Fragen:
F: Welches der folgenden Elemente hat die wenigsten Valenzelektronen?
A: Beryllium hat mit nur zwei die wenigsten Valenzelektronen.
F: Wofür wird Lithiumcarbonat verwendet?
A: Dilithiumcarbonat wird in stimmungsstabilisierenden Medikamenten zur Behandlung von bipolaren Störungen und Depressionen verwendet.
F: Ist Dilithiumcarbonat löslich?
A: Ja, Dilithiumcarbonat ist in begrenztem Umfang wasserlöslich.
F: Wie wirkt Lithiumcarbonat?
A: Dilithiumcarbonat stabilisiert die Stimmung und gleicht Neurotransmitter im Gehirn aus.
F: Was behandelt Lithiumcarbonat?
A: Dilithiumcarbonat wird in der psychiatrischen Medizin zur Behandlung von bipolaren Störungen und Depressionen eingesetzt.
F: Ist LiNO3 ionisch oder kovalent?
A: LiNO3 ist ionisch.
F: Welche der folgenden Substanzen ist in Wasser unlöslich? Li2CO3, NaOH, PbCl2, Ba(OH)2, (NH4)2S.
A: PbCl2 und Ba(OH)2 sind in Wasser unlöslich.
F: Ist Li2CO3 wasserlöslich?
A: Li2CO3 ist in Wasser schwer löslich.
F: Wie viele Ionen gibt es in Li2CO3?
A: Li2CO3 enthält drei Ionen: zwei Li+-Ionen und ein CO3^2–Ion.
F: Wie viele Formeleinheiten sind in 0,0067 g Li2CO3 enthalten?
A: In 0,0067 g Li2CO3 sind etwa 1,24 x 10^20 Formeleinheiten enthalten.
F: Wie viele Lithiumionen sind in 30,0 ml einer 0,600 M Li2CO3-Lösung enthalten?
A: In 30,0 ml einer 0,600 M Li2CO3-Lösung sind 0,036 Mol Li+-Ionen enthalten.
F: Wie hoch ist die Massenprozentzusammensetzung von Kohlenstoff in Lithiumcarbonat, Li2CO3?
A: Die Massenprozentzusammensetzung von Kohlenstoff in Li2CO3 beträgt etwa 11,3 %.
F: Welches der folgenden wässrigen Lösungspaare bildet beim Mischen von NH4NO3 + Li2CO3 einen Niederschlag?
A: NH4NO3 + Li2CO3 bilden keinen Niederschlag, da beide Verbindungen wasserlöslich sind.
