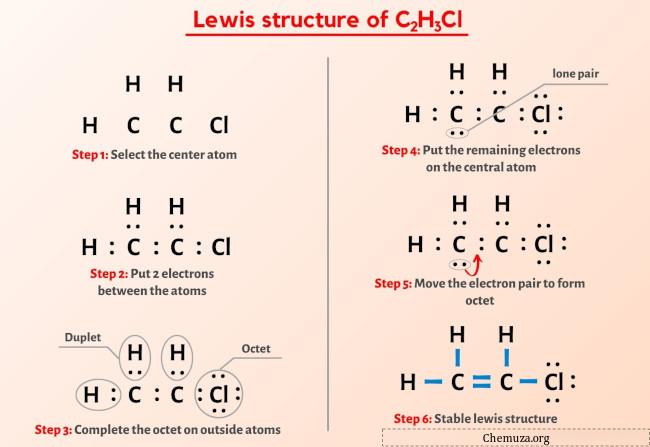
Sie haben das Bild oben also schon gesehen, oder?
Lassen Sie mich das obige Bild kurz erläutern.
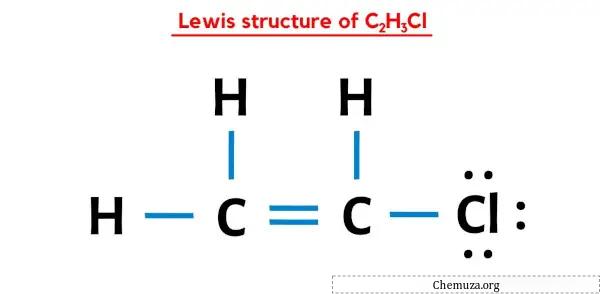
Die Lewis-Struktur C2H3Cl weist eine Doppelbindung zwischen Kohlenstoff-Kohlenstoff-Atomen und eine Einfachbindung zwischen Kohlenstoff-Wasserstoff-Atomen und Kohlenstoff-Chlor-Atomen auf. Es gibt 3 freie Elektronenpaare am Chloratom (Cl).
Wenn Sie aus dem obigen Bild der Lewis-Struktur von C2H3Cl nichts verstanden haben, bleiben Sie bei mir und Sie erhalten eine detaillierte Schritt-für-Schritt-Erklärung zum Zeichnen einer Lewis-Struktur von C2H3Cl .
Fahren wir also mit den Schritten zum Zeichnen der Lewis-Struktur von C2H3Cl fort.
Schritte zum Zeichnen der Lewis-Struktur von C2H3Cl
Schritt 1: Ermitteln Sie die Gesamtzahl der Valenzelektronen im C2H3Cl-Molekül
Um die Gesamtzahl der Valenzelektronen in einem C2H3Cl- Molekül zu ermitteln, müssen Sie zunächst die im Kohlenstoffatom, Wasserstoffatom und Chloratom vorhandenen Valenzelektronen kennen.
(Valenzelektronen sind die Elektronen, die sich in der äußersten Umlaufbahn eines Atoms befinden.)
Hier erkläre ich Ihnen, wie Sie mithilfe eines Periodensystems ganz einfach die Valenzelektronen von Kohlenstoff, Wasserstoff und Chlor finden.
Gesamtvalenzelektronen im C2H3Cl-Molekül
→ Vom Kohlenstoffatom gegebene Valenzelektronen:
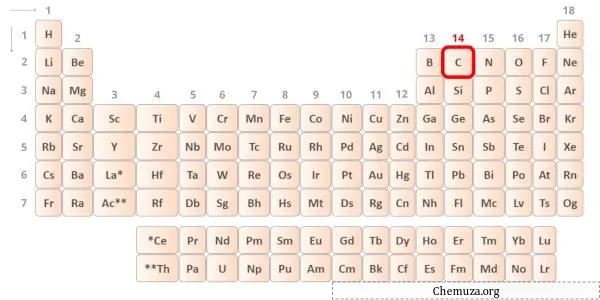
Kohlenstoff ist ein Element der Gruppe 14 des Periodensystems. [1] Daher sind im Kohlenstoff 4 Valenzelektronen vorhanden.
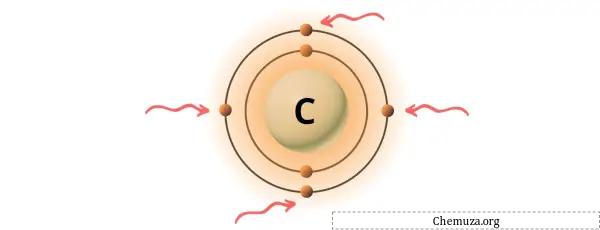
Sie können die 4 im Kohlenstoffatom vorhandenen Valenzelektronen sehen, wie im Bild oben gezeigt.
→ Vom Wasserstoffatom gegebene Valenzelektronen:
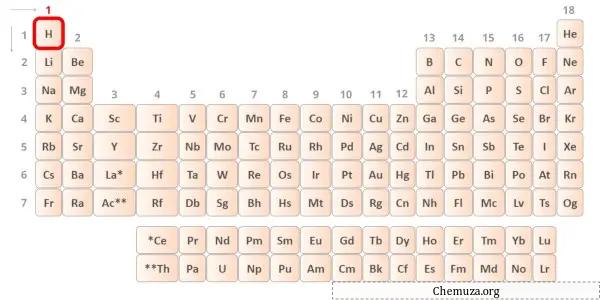
Wasserstoff ist ein Element der Gruppe 1 des Periodensystems. [2] Daher beträgt das im Wasserstoff vorhandene Valenzelektron 1 .

Sie können sehen, dass im Wasserstoffatom nur ein Valenzelektron vorhanden ist, wie im Bild oben gezeigt.
→ Vom Chloratom gegebene Valenzelektronen:

Chlor ist ein Element der Gruppe 17 des Periodensystems. [3] Daher sind in Chlor 7 Valenzelektronen vorhanden.
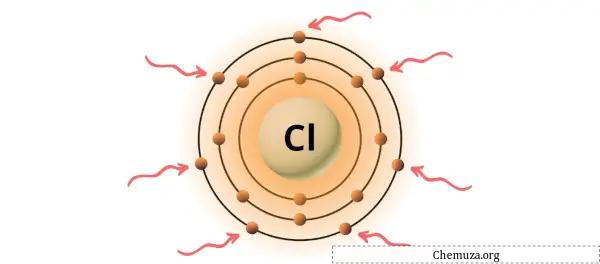
Sie können die 7 Valenzelektronen im Chloratom sehen, wie im Bild oben gezeigt.
Also,
Gesamte Valenzelektronen im C2H3Cl- Molekül = von 2 Kohlenstoffatomen gespendete Valenzelektronen + von 3 Wasserstoffatomen gespendete Valenzelektronen + von 1 Chloratom gespendete Valenzelektronen = 4(2) + 1(3) + 7 = 18 .
Schritt 2: Wählen Sie das Zentralatom aus
Um das Zentralatom auszuwählen, müssen wir bedenken, dass das am wenigsten elektronegative Atom im Zentrum verbleibt.
(Denken Sie daran: Wenn in dem angegebenen Molekül Wasserstoff vorhanden ist, platzieren Sie Wasserstoff immer an der Außenseite.)
Hier ist das gegebene Molekül C2H3Cl und enthält Kohlenstoffatome (C), Wasserstoffatome (H) und Chloratome (Cl).
Gemäß der Regel müssen wir also den Wasserstoff fernhalten.
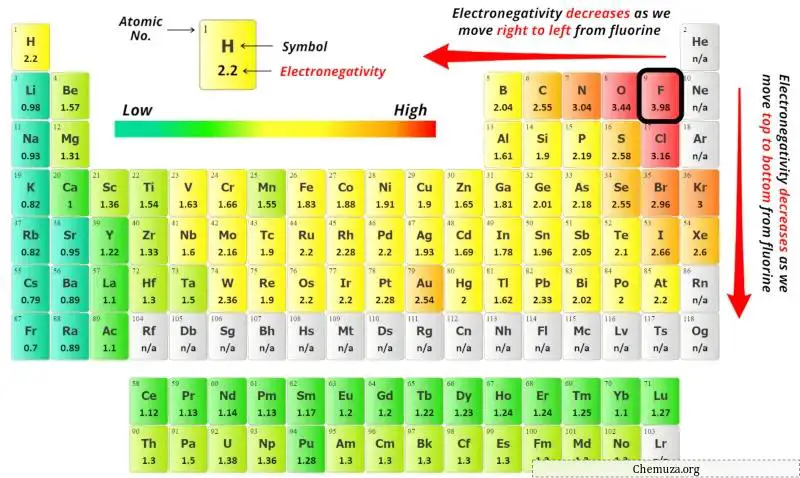
Jetzt können Sie die Elektronegativitätswerte des Kohlenstoffatoms (C) und des Chloratoms (Cl) im obigen Periodensystem sehen.
Wenn wir die Elektronegativitätswerte von Kohlenstoff (C) und Chlor (Cl) vergleichen, ist das Kohlenstoffatom weniger elektronegativ.
Hier ist das Kohlenstoffatom (C) das Zentralatom und das Chloratom (Cl) das Außenatom.

Schritt 3: Verbinden Sie jedes Atom, indem Sie ein Elektronenpaar zwischen ihnen platzieren
Nun müssen Sie im C2H3Cl-Molekül die Elektronenpaare zwischen den Kohlenstoffatomen (C) und den Chloratomen (Cl) sowie zwischen den Kohlenstoffatomen (C) und den Wasserstoffatomen (H) platzieren.
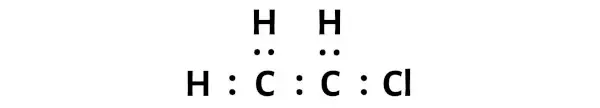
Dies weist darauf hin, dass diese Atome in einem C2H3Cl-Molekül chemisch miteinander verbunden sind.
Schritt 4: Machen Sie die externen Atome stabil
In diesem Schritt müssen Sie die Stabilität der externen Atome überprüfen.
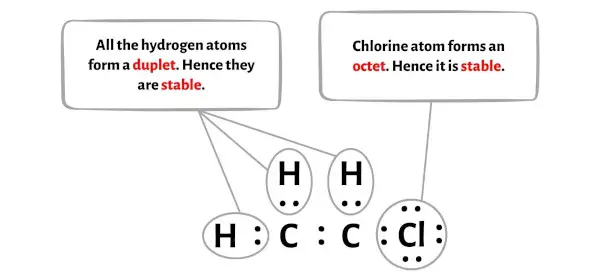
Hier in der Skizze des C2H3Cl-Moleküls sieht man, dass die äußeren Atome Wasserstoffatome und Chloratome sind.
Diese Wasserstoff- und Chloratome bilden ein Duplett bzw. ein Oktett und sind daher stabil.
Zusätzlich haben wir in Schritt 1 die Gesamtzahl der im C2H3Cl-Molekül vorhandenen Valenzelektronen berechnet.
Das C2H3Cl-Molekül verfügt über insgesamt 18 Valenzelektronen , von denen im obigen Diagramm nur 16 Valenzelektronen verwendet werden.
Die Anzahl der verbleibenden Elektronen beträgt also 18 – 16 = 2 .
Sie müssen diese beiden Elektronen auf einem der Kohlenstoffatome im obigen Diagramm des C2H3Cl-Moleküls platzieren.
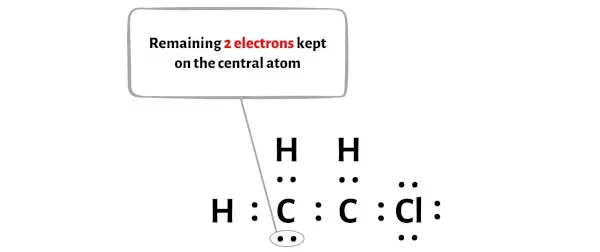
Kommen wir nun zum nächsten Schritt.
Schritt 5: Überprüfen Sie das Oktett am Zentralatom. Wenn es kein Oktett hat, verschieben Sie das freie Elektronenpaar, um eine Doppelbindung oder Dreifachbindung zu bilden.
In diesem Schritt müssen Sie prüfen, ob die zentralen Kohlenstoffatome (C) stabil sind oder nicht.
Um die Stabilität der zentralen Kohlenstoffatome (C) zu überprüfen, müssen wir prüfen, ob sie ein Oktett bilden oder nicht.
Leider bildet hier eines der Kohlenstoffatome kein Oktett.
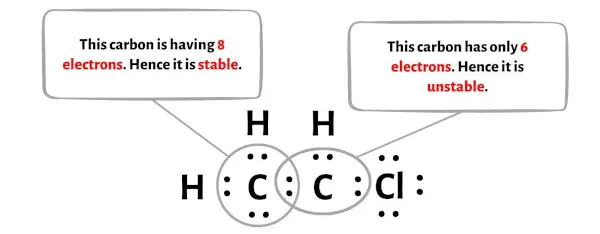
Um dieses Kohlenstoffatom nun stabil zu machen, müssen Sie das freie Elektronenpaar in eine Doppelbindung umwandeln, sodass das Kohlenstoffatom 8 Elektronen (dh ein Oktett) haben kann.
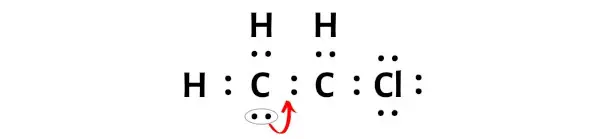
Nach der Umwandlung dieses Elektronenpaares in eine Doppelbindung erhält das zentrale Kohlenstoffatom zwei weitere Elektronen und seine Gesamtelektronenzahl beträgt somit 8.
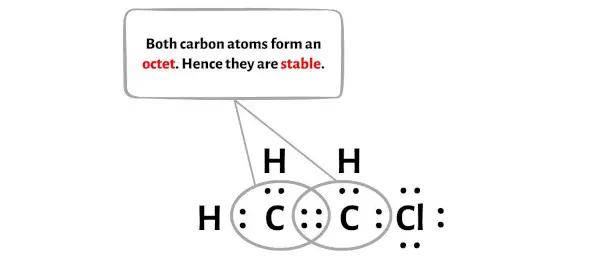
Im Bild oben sehen Sie, dass die beiden Kohlenstoffatome ein Oktett bilden.
Und deshalb sind diese Kohlenstoffatome stabil.
Fahren wir nun mit dem letzten Schritt fort, um zu überprüfen, ob die Lewis-Struktur von C2H3Cl stabil ist oder nicht.
Schritt 6: Überprüfen Sie die Stabilität der Lewis-Struktur
Jetzt sind Sie beim letzten Schritt angelangt, in dem Sie die Stabilität der Lewis-Struktur von C2H3Cl überprüfen müssen.
Die Stabilität der Lewis-Struktur kann mithilfe eines formalen Ladungskonzepts überprüft werden.
Kurz gesagt, wir müssen nun die formale Ladung der im C2H3Cl-Molekül vorhandenen Kohlenstoff- (C), Wasserstoff- (H) und Chloratome (Cl) ermitteln.
Um die formelle Steuer zu berechnen, müssen Sie die folgende Formel verwenden:
Formale Ladung = Valenzelektronen – (bindende Elektronen)/2 – nichtbindende Elektronen
Im Bild unten können Sie die Anzahl der bindenden und nichtbindenden Elektronen für jedes Atom des C2H3Cl-Moleküls sehen.
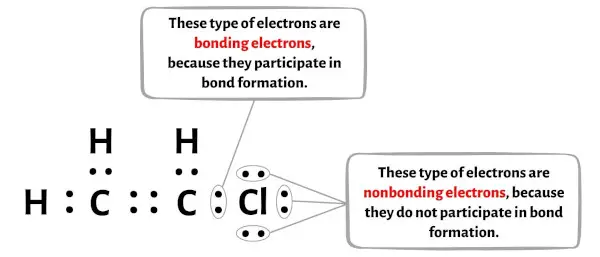
Für das Kohlenstoffatom (C):
Valenzelektronen = 4 (da Kohlenstoff in Gruppe 14 ist)
Bindungselektronen = 8
Nichtbindende Elektronen = 0
Für das Wasserstoffatom (H):
Valenzelektron = 1 (da Wasserstoff in Gruppe 1 ist)
Bindungselektronen = 2
Nichtbindende Elektronen = 0
Für das Chloratom (Cl):
Valenzelektronen = 7 (da Chlor in Gruppe 17 ist)
Bindungselektronen = 2
Nichtbindende Elektronen = 6
| Formelle Anklage | = | Valenzelektronen | – | (Bindungselektronen)/2 | – | Nichtbindende Elektronen | ||
| VS | = | 4 | – | 8/2 | – | 0 | = | 0 |
| H | = | 1 | – | 2/2 | – | 0 | = | 0 |
| Cl | = | 7 | – | 2/2 | – | 6 | = | 0 |
Aus den obigen Berechnungen der formalen Ladung können Sie ersehen, dass das Kohlenstoffatom (C), das Wasserstoffatom (H) sowie das Chloratom (Cl) eine formale Ladung von „Null“ haben.
Dies weist darauf hin, dass die obige Lewis-Struktur von C2H3Cl stabil ist und es keine weitere Änderung in der obigen Struktur von C2H3Cl gibt.
In der obigen Lewis-Punkt-Struktur von C2H3Cl können Sie jedes Bindungselektronenpaar (:) auch als Einfachbindung (|) darstellen. Dies führt zu der folgenden Lewis-Struktur von C2H3Cl.
Ich hoffe, Sie haben alle oben genannten Schritte vollständig verstanden.
Für mehr Übung und ein besseres Verständnis können Sie andere unten aufgeführte Lewis-Strukturen ausprobieren.
Probieren Sie zum besseren Verständnis diese Lewis-Strukturen aus (oder sehen Sie sie sich zumindest an):
