Kupfersulfat ist ein blauer kristalliner Feststoff mit der Formel CuSO4. Es wird häufig in der Landwirtschaft, als Fungizid und bei der Herstellung von Farbstoffen und Pigmenten eingesetzt.
| IUPAC-Name | Kupfer(II)sulfat |
| Molekularformel | CuSO4 |
| CAS-Nummer | 7758-98-7 |
| Synonyme | Blaues Vitriol, Kupfersulfat, Kupfersulfat, Kupfer(2+)salz der Schwefelsäure, Kupfer(II)sulfat, Kupfervitriol, blauer Stein |
| InChI | InChI=1S/Cu.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Molmasse von Kupfersulfat
Kupfersulfat hat eine Molmasse von 159.609 g/mol für die wasserfreie Form (CuSO4) und 249.685 g/mol für die Pentahydratform (CuSO4·5H2O). Die Molmasse ist die Summe der Atommassen aller Atome in einem Molekül. Die Molmasse von Kupfersulfat wird berechnet, indem die Atommasse eines Kupferatoms (Cu), eines Schwefelatoms (S) und vier Sauerstoffatome (O) in wasserfreier Form addiert wird, oder indem die Molmasse der wasserfreien Form mit addiert wird Molmasse von fünf Wassermolekülen (H2O) in der Pentahydratform.
Siedepunkt von Kupfersulfat
Kupfersulfat hat keinen bestimmten Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Allerdings verliert die Pentahydratform von Kupfersulfat beim Erhitzen Wassermoleküle, was zu wasserfreiem Kupfersulfat führt, das sich bei etwa 650 °C zersetzt. Die Zersetzung von Kupfersulfat ist ein endothermer Prozess, das heißt, es nimmt Wärme auf.
Schmelzpunkt von Kupfersulfat
Kupfersulfat hat einen Schmelzpunkt von 110 °C für die Pentahydratform und 650 °C für die wasserfreie Form. Der Schmelzpunkt ist die Temperatur, bei der ein fester Stoff in den flüssigen Zustand übergeht. Die Pentahydratform von Kupfersulfat schmilzt bei einer niedrigeren Temperatur als die wasserfreie Form, da Wassermoleküle vorhanden sind, die die Ionenbindungen zwischen Kupfer-, Schwefel- und Sauerstoffatomen zerstören können.
Dichte von Kupfersulfat g/ml
Kupfersulfat hat eine Dichte von 3,6 g/ml für die wasserfreie Form und 2,284 g/ml für die Pentahydratform. Die Dichte ist das Maß für die Masse pro Volumeneinheit. Die Dichte von Kupfersulfat wird durch die Anzahl der Wassermoleküle in seiner Struktur beeinflusst, da die Pentahydratform mehr Wassermoleküle pro Volumeneinheit enthält als die wasserfreie Form.
Molekulargewicht von Kupfersulfat
Kupfersulfat hat ein Molekulargewicht von 159.609 g/mol für die wasserfreie Form und 249.685 g/mol für die pentahydratisierte Form. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül. Das Molekulargewicht von Kupfersulfat wird in chemischen Reaktionen und Stöchiometrieberechnungen verwendet, um die benötigte oder produzierte Menge an Kupfersulfat zu bestimmen.
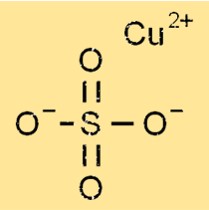
Struktur von Kupfersulfat
Kupfersulfat hat sowohl in wasserfreier als auch in Pentahydratform eine oktaedrische Struktur, wobei ein Kupferatom von vier Sauerstoffatomen und zwei Schwefelatomen umgeben ist. In der Pentahydratform sind fünf Wassermoleküle an die oktaedrische Struktur gebunden und bilden ein hydratisiertes Kristallgitter. Ionenbindungen zwischen Kupfer-, Schwefel-, Sauerstoff- und Wassermolekülen führen zur Kristallstruktur von Kupfersulfat.
Kupfersulfat-Formel
Die Formel für Kupfersulfat lautet CuSO4, was bedeutet, dass es aus einem Kupferatom (Cu), einem Schwefelatom (S) und vier Sauerstoffatomen (O) besteht. Es ist auch allgemein als Kupfer(II)sulfat oder blaues Vitriol bekannt. Die Formel gibt die Anzahl der Atome jedes in einem Molekül vorhandenen Elements an.
| Aussehen | Blauer kristalliner Feststoff |
| Spezifisches Gewicht | 3,6 (wasserfrei); |
| Farbe | Blau |
| Geruch | Geruchlos |
| Molmasse | 159.609 g/mol (wasserfrei); |
| Dichte | 3,6 g/ml (wasserfrei); |
| Fusionspunkt | 110°C (Pentahydrat); |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 31,6g/100ml (20°C) |
| Löslichkeit | Löslich in Methanol, Glycerin, schwer löslich in Ethanol, unlöslich in Ether |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 1,99 |
| pH-Wert | 3,5 – 4,5 |
Sicherheit und Gefahren von Kupfersulfat
Kupfersulfat kann bei unsachgemäßer Handhabung gesundheitsgefährdend sein. Beim Verschlucken ist es gesundheitsschädlich und kann bei Haut- oder Augenkontakt zu Reizungen oder Verbrennungen führen. Das Einatmen von Staub oder Dämpfen kann zu Reizungen oder Schäden an den Atemwegen führen. Es stellt außerdem eine potenzielle Gefahr für die Umwelt dar und kann für Wasserlebewesen giftig sein. Beim Umgang mit Kupfersulfat sind Vorsichtsmaßnahmen zu treffen, z. B. das Tragen von Schutzkleidung, Handschuhen und Schutzbrillen. Bei Verschlucken wenden Sie sich sofort an eine Giftnotrufzentrale oder suchen Sie einen Arzt auf. Bei Haut- oder Augenkontakt einige Minuten lang mit Wasser spülen und einen Arzt aufsuchen.
| Gefahrensymbole | Xi (irritierend) |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. Schutzhandschuhe und Augen-/Gesichtsschutz tragen. Bei Verschlucken einen Arzt konsultieren. |
| AN-Kennungen | UN3077 (für wasserfrei); UN1512 (für Pentahydrat) |
| HS-Code | 2833.25.00 |
| Gefahrenklasse | 9 (Verschiedene gefährliche Güter) |
| Verpackungsgruppe | III |
| Toxizität | Kann beim Verschlucken gesundheitsschädlich sein, Haut- und Augenreizungen verursachen und Reizungen der Atemwege verursachen. |
Methoden zur Kupfersulfatsynthese
Zur Synthese von Kupfersulfat stehen verschiedene Methoden zur Verfügung, beispielsweise die Reaktion von Kupfer mit Schwefelsäure oder von Kupferoxid bzw. Kupferhydroxid mit Schwefelsäure.
Um Kupfersulfat mit der ersten Methode zu synthetisieren, wird Kupfer in ein Reaktionsgefäß mit Schwefelsäure gegeben und Hitze zugeführt, um die Reaktion zu starten. Kupfer reagiert mit Schwefelsäure, wodurch Kupfersulfat und Wasser entstehen. Danach wird die resultierende Mischung abgekühlt und filtriert, um die Kupfersulfatkristalle von der verbleibenden Lösung abzutrennen.
Um Kupfersulfat zu synthetisieren, kann man Kupferoxid oder Kupferhydroxid in einem Reaktionsgefäß mit Schwefelsäure reagieren lassen. Nach der Reaktion wird die Mischung abgekühlt und die Kupfersulfatkristalle aus der verbleibenden Lösung abfiltriert.
Eine andere Methode besteht darin, Kupfer mit Schwefeldioxid und Sauerstoff in einem Reaktionsgefäß zur Reaktion zu bringen. Bei der Reaktion entstehen Kupfersulfat und Wasser. Die resultierende Mischung wird abgekühlt und filtriert, um die Kupfersulfatkristalle zu erhalten.
Zur Herstellung von Kupfersulfat kann man das Elektrolyseverfahren nutzen. Bei diesem Verfahren wird eine wässrige Kupfersulfatlösung einer Elektrolyse unterzogen, wodurch sich Kupfersulfat auf der Anode ablagert. Anschließend werden die Kupfersulfatkristalle von der Lösung abgetrennt und getrocknet.
Verwendung von Kupfersulfat
Zu den häufigsten Anwendungen von Kupfersulfat gehören:
- Wird als Dünger verwendet, um den Boden mit Kupfer zu versorgen, das für das Pflanzenwachstum unerlässlich ist. Wird als Pestizid zur Bekämpfung von Pilzkrankheiten in Nutzpflanzen eingesetzt.
- Wird Tierfutter als Kupferquelle zugesetzt und ist für das Wachstum und die Entwicklung der Tiere notwendig.
Industrie
- Wird beim Galvanisieren verwendet, um Kupfer auf der Oberfläche anderer Metalle abzuscheiden, was deren Korrosionsbeständigkeit verbessert.
- Wird bei der Wasseraufbereitung als Algizid und Flockungsmittel verwendet, um Algen und andere Verunreinigungen aus dem Wasser zu entfernen.
- Wird in der analytischen Chemie als Reagenz zur Bestimmung reduzierender Zucker und Proteine verwendet.
- Wird in der Textilindustrie als Beizmittel verwendet, um Farbstoffe auf Stoffen zu fixieren und ihnen eine lebendigere Farbe zu verleihen.
- Wird in der pharmazeutischen Industrie als Kupferquelle für Nahrungsergänzungsmittel und Medikamente verwendet.
- Wird auch bei der Herstellung von Pigmenten, Tinten und Farben sowie bei der Herstellung von Batterien, Katalysatoren und Holzschutzmitteln verwendet.
Fragen:
F: Ist Kupfersulfat wasserlöslich?
A: Ja, Kupfersulfat ist gut wasserlöslich. Bei Raumtemperatur kann es sich in Wasser bis zu maximal 203 Gramm pro 100 Milliliter Wasser auflösen.
F: Wo kann man in meiner Nähe Kupfersulfat kaufen?
A: Kupfersulfat ist in den meisten Baumärkten, Gartencentern und Online-Händlern leicht erhältlich. Sie können sich auch bei Ihrem örtlichen Hofladen oder Futtermittelhändler erkundigen, da Kupfersulfat häufig in der Landwirtschaft und als Tierfutter verwendet wird.
F: Wie viel Kupfersulfat pro Gallone Wasser?
A: Die Menge an Kupfersulfat, die pro Gallone Wasser benötigt wird, hängt von der jeweiligen Anwendung ab. In der Landwirtschaft beispielsweise liegt die empfohlene Aufwandmenge im Allgemeinen zwischen 1 und 10 Pfund pro Hektar. Bei der Wasseraufbereitung liegt die empfohlene Dosis im Allgemeinen zwischen 0,2 und 1,0 Milligramm pro Liter Wasser. Es ist wichtig, die Anweisungen auf dem Etikett des Kupfersulfatprodukts sorgfältig zu befolgen, um eine ordnungsgemäße Verwendung sicherzustellen.
F: Wie lautet die Formel für Kupfer(ii)sulfat?
A: Die Formel für Kupfer(II)sulfat lautet CuSO4.
