Kupferhydroxid (Cu(OH)2) ist ein blauer Feststoff, der durch die Reaktion von Kupfersalzen mit Hydroxidionen entsteht. Es wird als Fungizid und in verschiedenen chemischen Prozessen eingesetzt.
| IUPAC-Name | Kupfer(II)-hydroxid |
| Molekularformel | Cu(OH)2 |
| CAS-Nummer | 20427-59-2 |
| Synonyme | Kupferhydroxid; Kupferdihydroxid; CuOH2 |
| InChI | InChI=1S/Cu.2H2O/h;2*1H2/q+2;;/p-2 |
Eigenschaften von Kupferhydroxid
Kupferhydroxid-Formel
Die chemische Formel für Kupferhydroxid lautet Cu(OH)2. Es stellt die Kombination eines Kupferions (Cu2+) und zweier OH-Ionen dar, die durch Ionenbindungen zusammengehalten werden. Diese blaue Feststoffverbindung wird aufgrund ihrer einzigartigen Eigenschaften häufig in verschiedenen Branchen eingesetzt.
Molmasse von Kupferhydroxid
Die Molmasse von Kupferhydroxid (Cu(OH)2) kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Kupfer (Cu) hat eine Atommasse von etwa 63,55 g/mol und jedes OH-Ion hat eine kombinierte Atommasse von etwa 17,01 g/mol. Die Molmasse von Kupferhydroxid beträgt daher etwa 97,55 g/mol.
Siedepunkt von Kupferhydroxid
Kupferhydroxid hat keinen eindeutigen Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Beim Erhitzen kommt es zu einer thermischen Zersetzungsreaktion unter Bildung von Kupferoxid und Wasserdampf.
Schmelzpunkt von Kupferhydroxid
Kupferhydroxid hat einen Schmelzpunkt von etwa 200 °C (392 °F). Bei dieser Temperatur durchläuft der Feststoff einen Phasenübergang und geht in einen flüssigen Zustand über.
Dichte von Kupferhydroxid g/ml
Die Dichte von Kupferhydroxid beträgt etwa 3,36 g/ml. Dieser Wert stellt die Masse eines Milliliters Kupferhydroxid dar und gibt Aufschluss über dessen Kompaktheit und Konzentration.
Molekulargewicht von Kupferhydroxid
Das Molekulargewicht von Kupferhydroxid beträgt etwa 97,55 g/mol. Sie wird berechnet, indem die Atomgewichte aller in einem Kupferhydroxidmolekül vorhandenen Atome addiert werden.
Struktur von Kupferhydroxid
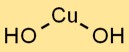
Kupferhydroxid nimmt eine kristalline Struktur an, wobei Cu2+-Ionen von OH–Ionen in einer trigonal-planaren Anordnung umgeben sind. Diese Kristallgitteranordnung trägt zu seiner Stabilität und seinen besonderen Eigenschaften bei.
Löslichkeit von Kupferhydroxid
Kupferhydroxid ist in Wasser nur begrenzt löslich. Es bildet eine Suspension, die in Wasser schlecht löslich ist, was bedeutet, dass sich nur eine geringe Menge der Verbindung im Lösungsmittel löst. Die Löslichkeit kann durch Faktoren wie Temperatur und pH-Wert beeinflusst werden.
| Aussehen | Durchgehend blau |
| Spezifisches Gewicht | ~3,36 g/ml |
| Farbe | Blau |
| Geruch | Geruchlos |
| Molmasse | ~97,55 g/Mol |
| Dichte | ~3,36 g/ml |
| Fusionspunkt | ~200°C (392°F) |
| Siedepunkt | Zersetzt |
| Blitzpunkt | N / A |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Begrenzt, variiert je nach Temperatur und pH-Wert |
| Dampfdruck | N / A |
| Wasserdampfdichte | N / A |
| pKa | N / A |
| pH-Wert | Alkalisch (basisch) |
Sicherheit und Gefahren von Kupferhydroxid
Kupferhydroxid wirft bestimmte Sicherheits- und Gefahrenaspekte auf. Es gilt im Allgemeinen als wenig toxisch, kann jedoch bei Kontakt oder Einatmen Reizungen der Haut, der Augen und der Atemwege verursachen. Beim Umgang mit dieser Verbindung sind angemessene Schutzmaßnahmen wie das Tragen von Handschuhen und einer Schutzbrille zu ergreifen. Bei Verschlucken oder versehentlicher Exposition ist sofortige ärztliche Hilfe erforderlich. Darüber hinaus sollte Kupferhydroxid an einem sicheren, gut belüfteten Ort, entfernt von inkompatiblen Substanzen, gelagert werden. Um eine Kontamination der Umwelt zu vermeiden, müssen ordnungsgemäße Entsorgungsverfahren befolgt werden. Die Einhaltung der Sicherheitsvorkehrungen ist entscheidend, um die potenziellen Risiken im Zusammenhang mit Kupferhydroxid zu minimieren.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Geringe Toxizität; Reizend |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 2825.90.5000 |
| Gefahrenklasse | Nicht als gefährlich eingestuft |
| Verpackungsgruppe | Nicht klassifiziert |
| Toxizität | Schwach |
Methoden zur Kupferhydroxid-Synthese
Es gibt mehrere aktive Methoden zur Synthese von Kupferhydroxid.
Ein üblicher Ansatz beinhaltet die Reaktion eines Cu-Salzes wie CuSO4 mit einer starken Base wie Natriumhydroxid (NaOH) oder Kaliumhydroxid (KOH) . Während dieses Prozesses verdrängen Hydroxidionen (OH-) aus der Base Sulfationen (SO4^2-) im CuSO4 und bilden Kupferhydroxid (Cu(OH)2) als blauen Niederschlag.
Eine andere Methode beinhaltet die Reaktion eines Kupfer(II)-Salzes mit Ammoniak (NH3). Durch die Zugabe von Ammoniak zu einer Cu(II)-Lösung fällt Kupferhydroxid aufgrund der Kombination von Cu2+-Ionen mit den Hydroxidionen von Ammoniak aus.
Die Elektrolyse ermöglicht die Synthese von Kupferhydroxid durch Eintauchen einer Cu-Elektrode in eine Elektrolytlösung und Anlegen eines elektrischen Gleichstroms. Durch die Reduktion von Wasser an der Kathode entstehen Hydroxidionen, die zur Bildung von Kupferhydroxid führen.
Diese aktiven Synthesemethoden bieten kontrollierte und effiziente Möglichkeiten zur Herstellung von Kupferhydroxid für verschiedene Industrie- und Forschungsanwendungen.
Verwendung von Kupferhydroxid
Kupferhydroxid findet aufgrund seiner einzigartigen Eigenschaften und Vielseitigkeit vielfältige Anwendungen in verschiedenen Branchen. Einige bemerkenswerte Verwendungszwecke sind:
- Fungizid: Landwirte verwenden es häufig als schützendes Fungizid zur Bekämpfung von Pilzkrankheiten in Nutzpflanzen wie Obst, Gemüse und Zierpflanzen.
- Chemische Zwischenprodukte: Es dient als wertvolles chemisches Zwischenprodukt bei der Synthese verschiedener Kupferverbindungen wie Kupferoxid und Kupfersalze.
- Holzschutzmittel: Es behandelt Holz und bietet Schutz vor holzfressenden Insekten und verrottenden Pilzen, wodurch die Lebensdauer von Holzkonstruktionen verlängert wird.
- Antibakterieller Wirkstoff: In einigen Formulierungen wirkt es als antibakterieller Wirkstoff und findet Anwendung in der Medizin und im Gesundheitswesen.
- Aquatische Behandlung: Hilft bei der Bekämpfung von Algen und Wasserunkräutern in Teichen, Seen und anderen Gewässern und sorgt so für die Aufrechterhaltung des ökologischen Gleichgewichts.
- Keramik- und Glasindustrie: Hersteller verwenden es als Farbstoff, um Keramik- und Glasprodukten leuchtende Blau- und Grüntöne zu verleihen.
- Pyrotechnik: Es trägt zur Färbung von Feuerwerkskörpern und Fackeln bei und spielt bei pyrotechnischen Anwendungen eine Rolle.
- Batterieherstellung: Es findet Verwendung bei der Herstellung von Batterien als Elektrodenmaterial und erleichtert die Energiespeicherung.
- Farben und Beschichtungen: Einige Farbformulierungen enthalten es, um schützende und antimikrobielle Eigenschaften zu verleihen.
Die Vielfalt der Anwendungen unterstreicht die Bedeutung von Kupferhydroxid in zahlreichen Branchen und macht es zu einer wertvollen Verbindung für verschiedene praktische Anwendungen.
Fragen:
F: Ist Kupferhydroxid löslich?
A: Kupferhydroxid ist in Wasser nur begrenzt löslich und bildet eine schlecht lösliche Suspension.
F: Wie viele Mol sind in 68 Gramm Kupfer(II)-hydroxid Cu(OH)2 enthalten?
A: In 68 Gramm sind etwa 0,697 Mol Cu(OH)2 enthalten.
F: Ist Kupfer-II-hydroxid wasserlöslich?
A: Kupfer(II)-hydroxid ist in Wasser nur begrenzt löslich.
F: Handelt es sich bei Natriumhydroxid und Kupfersulfat um eine chemische Reaktion?
A: Ja, die Reaktion zwischen NaOH und CuSO4 führt zur Bildung von Kupferhydroxid und Natriumsulfat.
F: Ist Kupfer(II)-hydroxid löslich?
A: Kupfer(II)-hydroxid ist in Wasser nur begrenzt löslich.
F: Welche Farbe hat Kupferhydroxid?
A: Kupferhydroxid hat eine blaue Farbe.
F: Ist Kupferhydroxid ein Alkali?
A: Kupferhydroxid ist eine Base, wird aber nicht als Alkali eingestuft.
F: Ist Kupferhydroxid eine starke Base?
A: Kupferhydroxid gilt nicht als starke Base.
F: Ist Cu(OH)2 wasserlöslich?
A: Cu(OH)2 ist in Wasser nur begrenzt löslich.
F: Wie viele Mol sind in 68 Gramm Kupfer(II)-hydroxid Cu(OH)2 enthalten?
A: In 68 Gramm sind etwa 0,697 Mol Cu(OH)2 enthalten.
F: Wie viele Mol sind in 34 Gramm Cu(OH)2 enthalten?
A: In 34 Gramm sind etwa 0,3485 Mol Cu(OH)2 enthalten.
F: Bildet sich ein festes Cu(OH)2, wenn 0,075 g KOH in 1,0 l Cu(NO3)2 bei 1,0 × 10^−3 M gelöst werden?
A: Ja, festes Cu(OH)2 bildet sich aufgrund der Reaktion zwischen KOH und Cu(NO3)2 als Niederschlag.
