Kupferfluorid (CuF2) ist eine Verbindung aus Kupfer und Fluor. Es weist eine grünlich-blaue Farbe auf und findet Anwendung in verschiedenen Branchen, darunter in der Elektronik und Katalyse.
| IUPAC-Name | Kupfer(II)fluorid |
| Molekularformel | CuF2 |
| CAS-Nummer | 7789-19-7 |
| Synonyme | Kupferfluorid, Kupferdifluorid |
| InChI | InChI=1S/2FH.Cu/h2*1H;/q;;+2/p-2 |
Eigenschaften von Kupferfluorid
Kupferfluorid-Formel
Die Formel für Kupferdifluorid lautet CuF2. Es besteht aus einem Kupferatom (Cu) und zwei Fluoratomen (F). Diese ionische Verbindung bildet aufgrund der elektrostatischen Anziehung zwischen dem positiv geladenen Kupferion und den negativ geladenen Fluoridionen eine stabile Kristallstruktur.
Molmasse von Kupferfluorid
Die Molmasse von Kupferdifluorid (CuF2) wird durch Addition der Atommassen seiner Bestandteile berechnet. Kupfer hat eine Molmasse von etwa 63,55 g/mol und Fluor hat eine Molmasse von etwa 18,99 g/mol. Addiert man beides, ergibt sich eine Molmasse von Kupferdifluorid von etwa 101,09 g/mol.
Siedepunkt von Kupferfluorid
Kupferdifluorid hat keinen genau definierten Siedepunkt, da es sich zersetzt, bevor es den Siedepunkt erreicht. Bei hohen Temperaturen beginnt sich Kupferdifluorid in Kupferdifluorid (CuF) und Fluorgas (F2) zu zersetzen. Daher gilt es als thermisch instabil.
Schmelzpunkt von Kupferfluorid
Kupferdifluorid hat einen Schmelzpunkt von etwa 840 °C (1544 °F). Bei dieser Temperatur absorbieren feste Kupferdifluoridkristalle genügend Energie, um in einen geschmolzenen Zustand überzugehen, sodass sie in einer Vielzahl von Hochtemperaturanwendungen eingesetzt werden können.
Dichte von Kupferfluorid g/ml
Die Dichte von Kupferdifluorid beträgt etwa 4,23 g/ml. Dieser Dichtewert weist darauf hin, dass Kupferdifluorid ein relativ dichtes Material ist, das für bestimmte Anwendungen nützlich sein kann, bei denen eine hohe Dichte erforderlich ist.
Molekulargewicht von Kupferfluorid
Das Molekulargewicht von Kupferdifluorid (CuF2) beträgt etwa 101,09 g/mol. Sie wird durch Addition der in der Formel vorhandenen Atomgewichte von Kupfer und zwei Fluoratomen berechnet.
Struktur von Kupferfluorid
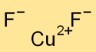
Kupferdifluorid nimmt eine Kristallstruktur an und bildet eine netzwerkartige Anordnung von Cu2+-Kationen und F–Anionen. Die Kupferkationen sind von sechs Fluoridionen umgeben und jedes Fluoridion steht in Kontakt mit drei Kupferionen.
Löslichkeit von Kupferfluorid
Kupferdifluorid hat eine geringe Wasserlöslichkeit. Es bildet schwerlösliche Salze, die Cu2+- und F–Ionen in die Lösung abgeben. Diese Eigenschaft ist bei verschiedenen chemischen Prozessen und Anwendungen wichtig, einschließlich der anorganischen Synthese und elektrochemischen Anwendungen.
| Aussehen | Grünlich-blauer Feststoff |
| Spezifisches Gewicht | 4,23 g/ml |
| Farbe | grünliches Blau |
| Geruch | Geruchlos |
| Molmasse | 101,09 g/Mol |
| Dichte | 4,23 g/cm³ |
| Fusionspunkt | 840 °C (1544 °F) |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwach, bildet schwerlösliche Salze |
| Löslichkeit | Schwer löslich |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Unzutreffend |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Kupferfluorid
Kupferdifluorid wirft mehrere Sicherheits- und Gefahrenaspekte auf. Direkter Kontakt mit der Verbindung kann zu Haut- und Augenreizungen führen. Das Einatmen von Staub oder Dämpfen kann Atemprobleme verursachen. Beim Erhitzen kann giftiges Fluorgas freigesetzt werden, das beim Einatmen gesundheitsschädlich ist. Daher sollte beim Umgang mit Kupferdifluorid für ausreichende Belüftung und persönliche Schutzausrüstung gesorgt werden. Darüber hinaus ist die Einnahme unbedingt zu vermeiden, da dies zu Magen-Darm-Beschwerden führen kann. Um Reaktionen zu vermeiden, sollte die Verbindung in verschlossenen Behältern fern von inkompatiblen Materialien gelagert werden. Um die mit Kupferdifluorid verbundenen Risiken zu minimieren, sind geeignete Sicherheitsprotokolle und Handhabungspraktiken unerlässlich.
| Gefahrensymbole | Reizend |
| Sicherheitsbeschreibung | Verursacht Haut- und Augenreizungen. Gesundheitsschädlich beim Einatmen. Kann beim Erhitzen giftiges Fluorgas freisetzen. Vermeiden Sie die Einnahme. Verwenden Sie geeignete Belüftungs- und Schutzausrüstung. |
| UN-Identifikationsnummern | N / A |
| HS-Code | 2826.92.00 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | III |
| Toxizität | Giftig |
Methoden zur Kupferfluorid-Synthese
Es gibt verschiedene Methoden zur Synthese von Kupferdifluorid. Ein üblicher Ansatz besteht darin, Kupferoxid (CuO) oder Kupfercarbonat (CuCO3) in einen Behälter zu geben und sorgfältig zu rühren, während Flusssäure (HF) in den Behälter gegeben wird. Die Reaktion läuft weiter und erzeugt als Nebenprodukte Kupferdifluorid und Wasser.
Eine andere Methode besteht darin, metallisches Kupfer oder Kupferpulver mit Fluorgas (F2) bei hohen Temperaturen zur Reaktion zu bringen. Aufgrund der Reaktivität von Fluorgas erfordert dieser Prozess eine sorgfältige Handhabung. Es bildet Kupferdifluorid direkt durch die Verbindung von Kupfer- und Fluoratomen.
Darüber hinaus kann die Herstellung von Kupferdifluorid durch die Reaktion von Kupfer(II)-chlorid (CuCl2) mit Natriumfluorid (NaF) in einer wässrigen Lösung erfolgen. Bei der Reaktion entstehen Kupferdifluorid sowie Natriumchlorid als Nebenprodukt.
Diese Synthesemethoden erfordern aufgrund der Reaktivität einiger beteiligter Chemikalien Sicherheitsmaßnahmen und geeignete Ausrüstung. Eine genaue Kontrolle der Reaktionsbedingungen ist entscheidend, um hohe Ausbeuten an reinem Kupferdifluorid zu erzielen.
Verwendung von Kupferfluorid
Kupferdifluorid findet aufgrund seiner einzigartigen Eigenschaften und Eigenschaften eine Reihe wertvoller Anwendungen. Hier sind einige wichtige Verwendungszwecke:
- Elektronik: Kupferdifluorid wird in der Halbleiterindustrie als Kupferionenquelle für Dünnschichtabscheidungsprozesse verwendet. Es gilt als Pionier in der Herstellung elektronischer Geräte und integrierter Schaltkreise.
- Katalyse: Es fungiert als Katalysator bei verschiedenen chemischen Reaktionen, einschließlich der Synthese organischer Verbindungen und bei industriellen Prozessen wie Fluorierungsreaktionen.
- Fluorquelle: Kupferdifluorid wird zur Herstellung von Fluorgas (F2) durch Hochtemperaturzersetzung verwendet, das für verschiedene industrielle Anwendungen unerlässlich ist.
- Keramik und Glas: Die Verbindung wird als Zusatzstoff bei der Herstellung von Keramik und Glas verwendet, um die Eigenschaften des Materials zu modifizieren und seine Leistung zu verbessern.
- Dentalmaterialien: Kupferdifluorid wird in Dentalprodukte wie Zahnpasta und Mundwässer eingearbeitet, um deren karieshemmende und antibakterielle Eigenschaften zu verbessern.
- Beschichtungen: Es wird in Spezialbeschichtungen verwendet, beispielsweise als Antireflexbeschichtungen für optische Geräte und Schutzbeschichtungen für Metalloberflächen.
- Flammschutzmittel: Kupferdifluorid wird als Zusatzstoff in flammhemmenden Materialien verwendet und trägt dazu bei, die Entflammbarkeit verschiedener Produkte zu verringern.
- Chemisches Reagenz: In Laboren und Forschung wird Kupferdifluorid als Reagenz bei bestimmten chemischen Reaktionen und Analysen verwendet.
Die Vielseitigkeit von Kupferdifluorid macht es in allen Branchen wertvoll, von der Elektronik bis zum Gesundheitswesen, wo seine einzigartigen Eigenschaften zur Verbesserung von Leistung und Sicherheit genutzt werden. Aufgrund seiner Reaktivität und potenziellen Gefahren sind jedoch eine ordnungsgemäße Handhabung und Sicherheitsvorkehrungen unerlässlich.
Fragen:
F: Wie lautet die Massenformel von Kupfer(II)fluorid?
A: Die Formelmasse von Kupfer(II)-difluorid (CuF2) beträgt etwa 101,09 g/mol.
F: Welche der folgenden Formeln ist für Kupfer(II)-Fluorid richtig?
A: Die korrekte Formel für Kupfer(II)-difluorid ist CuF2.
F: Reinigt Kupfer Fluorid?
A: Nein, Kupfer reinigt Difluorid nicht. Kupfer hat nicht die Fähigkeit, Difluorid aus Wasser zu entfernen.
F: Was ist die kovalente Verbindung von NaCl, KCl, CuF2 und CF4?
A: Die kovalente Verbindung ist CF4 (Tetrafluorkohlenstoff).
F: Was entsteht an den Elektroden, wenn eine wässrige Lösung von CuF2 elektrolysiert wird?
A: An der Anode entsteht gasförmiger Sauerstoff (O2) und an der Kathode metallisches Kupfer (Cu).
F: Wie heißt CuF2 im Stock-System?
A: Der Name von CuF2 im Stock-System ist Kupfer(II)-difluorid.
F: Welche Ladung hat das Kupferion in der Verbindung CuF2?
A: Die Ladung des Kupferions in CuF2 beträgt +2.
F: Ist CuF2 ionisch oder molekular?
A: CuF2 ist eine ionische Verbindung.
F: Welche Ladung hat die ionische Verbindung CuF2?
A: Die ionische Verbindung CuF2 ist neutral.
F: Wie heißt die Verbindung mit der Formel CuF2?
A: Der Name der Verbindung mit der Formel CuF2 ist Kupfer(II)-difluorid.
