Kupfercarbonat (CuCO3) ist eine blaugrüne Verbindung, die auf natürliche Weise durch die Reaktion von Cu-Salzen mit Carbonationen entsteht. Es hat verschiedene industrielle Anwendungen, darunter Pigmente und Fungizide.
| IUPAC-Name | Kupfer(II)carbonat |
| Molekularformel | CuCO3 |
| CAS-Nummer | 1184-64-1 |
| Synonyme | Basisches Kupfercarbonat, Kupfercarbonat, Kupfermonocarbonat |
| InChI | InChI=1S/CH2O3.Cu/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Eigenschaften von Kupfercarbonat
Kupfercarbonat-Formel
Die chemische Formel für Kupfercarbonat lautet CuCO3. Es stellt eine Kombination aus einem Kupferatom (Cu), einem Kohlenstoffatom (C) und drei Sauerstoffatomen (O) dar. Diese Formel liefert entscheidende Informationen über die elementare Zusammensetzung der Verbindung.
Molmasse von Kupfercarbonat
Kupfercarbonat hat eine Molmasse von etwa 123,55 Gramm pro Mol (g/mol). Die Molmasse ist die Summe der Atommassen aller in einem Mol einer Substanz vorhandenen Atome und wird in Gramm pro Mol ausgedrückt.
Siedepunkt von Kupfercarbonat
Kupfercarbonat hat keinen ausgeprägten Siedepunkt, da es beim Erhitzen auf etwa 200 °C in CuO und Kohlendioxid zerfällt. Daher unterliegt es eher einer thermischen Zersetzung als einem Siedevorgang.
Kupfercarbonat Schmelzpunkt
Kupfercarbonat hat einen Schmelzpunkt von etwa 200 °C (392 °F). Bei dieser Temperatur geht das feste Kupfercarbonat in den flüssigen Zustand über. Allerdings ist zu beachten, dass es sich vor Erreichen des Siedepunktes zersetzt.
Dichte von Kupfercarbonat g/ml
Die Dichte von Kupfercarbonat beträgt etwa 3,6 Gramm pro Milliliter (g/ml). Die Dichte misst die Masse einer Substanz pro Volumeneinheit und gibt an, wie dicht ihre Partikel zusammengepackt sind.
Molekulargewicht von Kupfercarbonat
Das Molekulargewicht von Kupfercarbonat, auch Molmasse genannt, beträgt etwa 123,55 g/mol. Dieser Wert ist für verschiedene chemische Berechnungen und Umrechnungen von entscheidender Bedeutung.
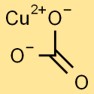
Struktur von Kupfercarbonat
Kupfercarbonat nimmt eine trigonal-planare Struktur an. Das zentrale Kupferatom ist von drei Sauerstoffatomen und einer Carbonatgruppe umgeben, die aus einem Kohlenstoffatom und drei miteinander verbundenen Sauerstoffatomen besteht.
Löslichkeit von Kupfercarbonat
Kupfercarbonat ist in Wasser schlecht löslich, das heißt, es löst sich nur begrenzt auf. Die Löslichkeit wird durch Faktoren wie Temperatur und pH-Wert beeinflusst. Es reagiert mit Säuren unter Bildung von Kupfersalzen und setzt Kohlendioxid frei.
| Aussehen | Blaugrüner Feststoff |
| Spezifisches Gewicht | ~3,6 g/ml |
| Farbe | Blau Grün |
| Geruch | Geruchlos |
| Molmasse | ~123,55 g/Mol |
| Dichte | ~3,6 g/ml |
| Fusionspunkt | ~200°C (392°F) |
| Siedepunkt | Zersetzt sich bei ~200°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwer löslich, abhängig von Temperatur und pH-Wert |
| Löslichkeit | In den meisten Lösungsmitteln unlöslich |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Alkalisch (basisch) |
Sicherheit und Gefahren von Kupfercarbonat
Kupfercarbonat bringt bestimmte Sicherheits- und Gefahrenaspekte mit sich. Es ist wichtig, vorsichtig damit umzugehen, um mögliche Risiken zu vermeiden. Direkter Kontakt mit der Haut, den Augen oder das Einatmen von Staub kann zu Reizungen und Beschwerden führen. Eine längere Exposition oder Einnahme kann schädlich sein und zu schwerwiegenderen Gesundheitsproblemen führen. Beim Erhitzen können giftige Dämpfe, einschließlich Kohlendioxid, freigesetzt werden, die eine ausreichende Belüftung erfordern. Darüber hinaus ist Kupfercarbonat in Pulverform brennbar und erfordert eine sorgfältige Lagerung und Handhabung, um Brandgefahr zu vermeiden. Um die Sicherheit zu gewährleisten, befolgen Sie stets die Sicherheitsvorkehrungen, tragen Sie geeignete Schutzausrüstung und lagern Sie die Verbindungen getrennt von inkompatiblen Materialien.
| Gefahrensymbole | Reizend, gefährlich |
| Sicherheitsbeschreibung | Mit Vorsicht behandeln. Vermeiden Sie direkten Kontakt. In gut belüfteten Bereichen verwenden. Befolgen Sie die Sicherheitshinweise und tragen Sie Schutzausrüstung. |
| UN-Identifikationsnummern | Nicht zugeschrieben |
| HS-Code | 2836.40.0000 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität; kann bei Kontakt Reizungen und Beschwerden verursachen; Vermeiden Sie Verschlucken und Einatmen. |
Methoden zur Kupfercarbonat-Synthese
Es gibt verschiedene Methoden zur Synthese von Kupfercarbonat, die alle die Kombination von Cu-Salzen mit Carbonatquellen beinhalten. Ein gängiger Ansatz besteht darin, CuSO4 mit Natriumcarbonat (Na2CO3) in einer wässrigen Lösung umzusetzen. Bei dieser Reaktion entsteht ein Niederschlag von Kupfercarbonat, der durch Filtration abgetrennt und anschließend getrocknet wird, um das feste Produkt zu erhalten.
Eine andere Methode beinhaltet die Reaktion von CuCl2 mit Natriumcarbonat oder Natriumbicarbonat (NaHCO3) in einer ähnlichen wässrigen Umgebung. Bei dieser Reaktion entstehen als Nebenprodukt Kupfercarbonat und Natriumchlorid (NaCl).
Darüber hinaus bildet das Durchperlen von Kohlendioxid (CO2) durch eine Cu(OH)2-Lösung bei der Hydroxidumwandlung einen Kupfercarbonat-Niederschlag.
Das Metall Cu interagiert in einer kontrollierten Umgebung mit Kohlendioxidgas, um Kupfercarbonat zu erzeugen.
Die Kontrolle der Reaktionsbedingungen wie Temperatur und Konzentration ist entscheidend für das Erreichen der gewünschten Ausbeuten und Reinheit. Diese Methoden ermöglichen die Herstellung von Kupfercarbonat für verschiedene industrielle Anwendungen, einschließlich seiner Verwendung als Pigment, Fungizid oder in anderen chemischen Prozessen.
Verwendung von Kupfercarbonat
Kupfercarbonat findet aufgrund seiner einzigartigen Eigenschaften vielseitige Anwendungen in verschiedenen Branchen. Hier sind einige wichtige Verwendungszwecke von Kupfercarbonat:
- Pigmente: Kupfercarbonat verleiht Farben, Keramik und Kunststoffen leuchtende blaugrüne Farbtöne und verbessert so deren Aussehen.
- Landwirtschaftliches Fungizid: Es dient wirksam als Fungizid in der Landwirtschaft, schützt Nutzpflanzen vor Pilzinfektionen und fördert ein gesundes Pflanzenwachstum.
- Holzschutz: Kupfercarbonat wird in Holzschutzformulierungen verwendet und schützt Holz vor Fäulnis und Insektenschäden.
- Galvanisieren: Es vereinfacht Galvanisierungsprozesse entscheidend und ermöglicht die Abscheidung einer Kupferbeschichtung auf verschiedenen Metalloberflächen, wodurch die Leitfähigkeit und Korrosionsbeständigkeit verbessert werden.
- Katalysator: Kupfercarbonat fungiert als aktiver Katalysator in mehreren chemischen Reaktionen und beschleunigt die Reaktionsgeschwindigkeiten, ohne dass es selbst wesentliche Veränderungen erfährt.
- Algizid: Bei der Wasseraufbereitung wirkt es aktiv als Algizid und kontrolliert das Algenwachstum in Tanks, Teichen und Wassersystemen.
- Glasherstellung: Kupfercarbonat trägt aktiv zur Herstellung von grün getönten Glasprodukten wie Flaschen und dekorativen Glaswaren in der Glasindustrie bei.
- Künstlicher Schmuck: Bei der Herstellung von künstlichem Schmuck wird aktiv Kupfercarbonat verwendet, was eine erschwingliche Alternative zu echtem Schmuck auf Kupferbasis darstellt.
- Analytische Chemie: Kupfercarbonat findet aktive Verwendung als Reagenz in der analytischen Chemie zur Durchführung verschiedener Tests und Experimente.
- Feuerwerk und Pyrotechnik: Es trägt aktiv zur leuchtend grünen Farbe von Feuerwerk und pyrotechnischen Shows bei.
Die Vielfalt der Anwendungen unterstreicht die Bedeutung von Kupfercarbonat als wertvolle chemische Verbindung in vielen Branchen, die sowohl Produkte als auch Prozesse verbessert.
Fragen:
F: Wie viele Mol Sauerstoffatome sind in 5,67 Mol Kupfer(II)carbonat enthalten?
A: In 5,67 Mol Kupfer(II)carbonat gibt es 17,01 Mol Sauerstoffatome (3 Sauerstoffatome für 1 Mol CuCO3).
F: Ist Kupfercarbonat löslich?
A: Kupfercarbonat ist in Wasser schlecht löslich.
F: Welches Element leitet Elektrizität eher durch: Kupfer, Kohlenstoff, Helium oder Schwefel?
A: Kupfer ist das Element, das am ehesten Strom durchlässt, da es ein guter Stromleiter ist.
F: Wie stellt man Kupfercarbonat her?
A: Kupfercarbonat kann durch Reaktion von Cu-Salzen mit Carbonatquellen wie Natriumcarbonat oder durch Durchperlen von Kohlendioxid durch eine Lösung von Cu(OH)2 hergestellt werden.
F: Wie verwendet man Kupfercarbonat in Töpferwaren?
A: Kupfercarbonat wird in der Töpferei als Keramikglasur verwendet, um fertigen Stücken eine blaugrüne Farbe zu verleihen.
F: Ist CuCO3 wasserlöslich?
A: CuCO3 ist in Wasser schlecht löslich.
F: Wie könnte man eine Fällungsreaktion zur Vorbereitung einer CuCO3-Probe nutzen?
A: Um CuCO3 durch eine Fällungsreaktion herzustellen, können Sie ein lösliches Cu-Salz mit einem löslichen Carbonatsalz mischen, was zur Bildung von unlöslichem Kupfercarbonat führt, das durch Filtration abgetrennt werden kann.
F: Wie heißt die Verbindung CuCO3?
A: Die Verbindung CuCO3 wird Kupfer(II)-carbonat genannt.
F: Wie groß ist die Molmasse von CuCO3?
A: Die Molmasse von CuCO3 beträgt etwa 123,55 g/mol.
F: Ist CuCO3 löslich oder unlöslich?
A: CuCO3 ist in den meisten Lösungsmitteln, einschließlich Wasser, unlöslich.
F: Woraus besteht Kupfer(II)-carbonat?
A: Kupfer(II)carbonat besteht aus einem Cu-Atom, einem Kohlenstoffatom (C) und drei Sauerstoffatomen (O).
