Kupferbromid (CuBr2) ist eine Verbindung aus Kupfer und Brom. Es weist eine blaugrüne Farbe auf und wird häufig in der organischen Synthese und als Lewis-Säure-Katalysator verwendet.
| IUPAC-Name | Kupfer(II)bromid |
| Molekularformel | CuBr2 |
| CAS-Nummer | 7789-45-9 |
| Synonyme | Kupferbromid, Kupferdibromid |
| InChI | InChI=1S/Br2.Cu |
Eigenschaften von Kupferbromid
Kupferbromid-Formel
Die Formel für Kupferbromid lautet CuBr2. Es stellt eine Verbindung dar, die aus einem Kupferatom und zwei Bromatomen besteht. Diese Kombination führt zu einer blaugrünen kristallinen Substanz, die üblicherweise in verschiedenen chemischen Reaktionen verwendet wird.
Molmasse von Kupferbromid
Die Molmasse von Kupferbromid beträgt etwa 223,36 Gramm pro Mol. Dieser Wert ergibt sich aus der Addition der Atommassen eines Kupferatoms (Cu) und zweier Bromatome (Br), die in der Formel CuBr2 enthalten sind.
Siedepunkt von Kupferbromid
Kupferbromid hat einen Siedepunkt von etwa 1.294 Grad Celsius (etwa 2.361 Grad Fahrenheit). Diese Temperatur gibt den Punkt an, an dem die Substanz unter normalem Atmosphärendruck von flüssig in gasförmig übergeht.
Schmelzpunkt von Kupferbromid
Der Schmelzpunkt von Kupferbromid liegt bei etwa 498 Grad Celsius (etwa 928 Grad Fahrenheit). Diese Temperatur stellt den Punkt dar, an dem der Feststoff beim Erhitzen in den flüssigen Zustand übergeht.
Dichte von Kupferbromid g/ml
Die Dichte von Kupferbromid beträgt bei normaler Raumtemperatur und Atmosphärendruck etwa 4,71 Gramm pro Milliliter (g/ml). Dieser Wert gibt an, wie viel Masse pro Volumeneinheit des Stoffes vorhanden ist.
Molekulargewicht von Kupferbromid
Kupferbromid hat ein Molekulargewicht von etwa 223,36 Gramm pro Mol. Dieser Wert ist für verschiedene chemische Berechnungen von entscheidender Bedeutung und dient als Referenz für die in einer bestimmten Probe vorhandene Substanzmenge.
Struktur von Kupferbromid
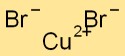
Kupferbromid hat eine Kristallgitterstruktur, in der Kupferatome von Bromatomen umgeben sind und umgekehrt. Diese Anordnung bildet ein stabiles und geordnetes Muster, das zu den physikalischen Eigenschaften der Verbindung beiträgt.
Löslichkeit von Kupferbromid
Kupferbromid ist in Wasser nur begrenzt löslich. Es ist in organischen Lösungsmitteln besser löslich. Die Löslichkeit hängt von Faktoren wie der Temperatur und der Art des verwendeten Lösungsmittels ab. Das Verständnis seiner Löslichkeit ist für verschiedene Anwendungen in Chemie und Industrie von entscheidender Bedeutung.
| Aussehen | Blaugrüne Kristalle |
| Spezifisches Gewicht | Nicht verfügbar |
| Farbe | Blau Grün |
| Geruch | Geruchlos |
| Molmasse | 223,36 g/Mol |
| Dichte | 4,71 g/ml |
| Fusionspunkt | 498 °C (928 °F) |
| Siedepunkt | 1294 °C (2361 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Begrenzte Löslichkeit |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie Ethanol, Ether und Benzol |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Nicht verfügbar |
Sicherheit und Gefahren von Kupferbromid
Kupferbromid wirft bestimmte Sicherheits- und Gefahrenaspekte auf. Aufgrund seiner potenziellen Toxizität und reizenden Eigenschaften ist es wichtig, mit dieser Verbindung vorsichtig umzugehen. Direkter Kontakt mit der Haut oder den Augen kann zu Reizungen und Beschwerden führen. Das Einatmen von Staub oder Dämpfen kann zu Reizungen der Atemwege führen. Daher sollte bei der Arbeit mit Kupferbromid geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden. Darüber hinaus sollte es fern von inkompatiblen Substanzen gelagert werden, um mögliche Reaktionen zu vermeiden. Bei Verschlucken oder versehentlicher Exposition sofort einen Arzt aufsuchen. Die Einhaltung der Sicherheitsvorkehrungen ist entscheidend, um eine sichere Handhabung und Verwendung von Kupferbromid zu gewährleisten.
| Gefahrensymbole | Reizend, Ätzend |
| Sicherheitsbeschreibung | Mit Anzahlung umgehen. Vermeiden Sie direkten Kontakt mit Haut und Augen. Verwenden Sie geeignete Schutzausrüstung. |
| UN-Identifikationsnummern | Nicht verfügbar |
| HS-Code | Nicht verfügbar |
| Gefahrenklasse | Reizend |
| Verpackungsgruppe | Nicht verfügbar |
| Toxizität | Kann Haut- und Augenreizungen verursachen. Das Einatmen von Staub oder Dämpfen kann zu Reizungen der Atemwege führen. |
Methoden zur Synthese von Kupferbromid
Es gibt verschiedene Methoden zur Synthese von Kupferbromid (CuBr2). Ein gängiger Ansatz ist die direkte Kombination von metallischem Kupfer oder Kupferoxid mit Bromwasserstoffsäure . Bei dieser Methode fügen wir der Säure Kupfer hinzu und es kommt zu einer chemischen Reaktion, die zur Bildung von Kupferbromid und zur Freisetzung von Wasserstoffgas führt.
Eine andere Methode ist die Reaktion zwischen Kupfercarbonat oder Kupferhydroxid mit Bromwasserstoffsäure. Das Carbonat oder Hydroxid reagiert mit der Säure unter Bildung von Kupferbromid, Wasser und Kohlendioxid.
Darüber hinaus kann zur Synthese von Kupferbromid eine doppelte Verdrängungsreaktion eingesetzt werden. Bei dieser Methode kommt es zur Reaktion zwischen einem löslichen Kupfersalz, beispielsweise Kupfersulfat, und einem löslichen Bromidsalz, beispielsweise Natriumbromid. Die Reaktion führt zur Bildung von Kupferbromid und einem löslichen Salz des anderen bei der Reaktion vorhandenen Metalls oder Metalloids.
Darüber hinaus können wir zur Synthese von Kupferbromid elektrochemische Methoden anwenden. Bei diesen Methoden kommt eine elektrochemische Zelle mit Kupferelektroden und einer Bromidionenquelle zum Einsatz. Wenn wir Strom anlegen, bildet sich an einer Elektrode Kupferbromid, während an der anderen Elektrode Bromgas freigesetzt wird.
Die Wahl der Synthesemethode hängt von Faktoren wie der Verfügbarkeit der Reagenzien, der gewünschten Reinheit und dem Ausmaß der Reaktion ab. Bei allen synthetischen Verfahren sollten die richtige Handhabung und Sicherheitsvorkehrungen beachtet werden.
Verwendung von Kupferbromid
Kupferbromid (CuBr2) findet aufgrund seiner einzigartigen Eigenschaften vielseitige Anwendungen in verschiedenen Branchen. Hier sind einige seiner bemerkenswerten Verwendungsmöglichkeiten:
- Organische Synthese : Kupferbromid dient als Katalysator in vielen organischen Reaktionen, wie der Ullmann-Kupplung und der Wurtz-Fittig-Reaktion, und ermöglicht die Bildung von Kohlenstoff-Kohlenstoff- und Kohlenstoff-Heteroatom-Bindungen.
- Fotografie : Es wird in fotografischen Prozessen verwendet, um Emulsionen zu sensibilisieren und die Empfindlichkeit von Filmen und Platten zu verbessern, wodurch die Aufnahme hochwertiger Bilder erleichtert wird.
- Galvanisieren : Kupferbromid wird in Galvanikprozessen verwendet, um Kupferschichten auf Oberflächen abzuscheiden und so für Korrosionsbeständigkeit und dekorative Oberflächen zu sorgen.
- Halbleiterindustrie : Im Elektroniksektor wird es bei der Synthese von Nanokristallen auf Basis von Kupferbromid verwendet, die in der Optoelektronik und Photonik Anwendung finden.
- Flammenfarbstoff : Kupferbromid wird in der Pyrotechnik und bei Feuerwerkskörpern verwendet, um eine grüne Flammenfarbe zu erzeugen, die den Displays einen optischen Reiz verleiht.
- Medizin : Obwohl begrenzt, wurde es aufgrund seiner antibakteriellen Eigenschaften für potenzielle therapeutische Anwendungen erforscht.
- Lasertechnologie : Kupferbromidlaser werden in der wissenschaftlichen Forschung, bei laserinduzierten Fluoreszenzstudien und zur Erzeugung hochenergetischer Laserimpulse eingesetzt.
- Chemische Analyse : Sie wird in der analytischen Chemie für qualitative und quantitative Analysen verwendet.
- Bromierungsreaktionen : Kupferbromid fungiert als Bromierungsmittel und erleichtert die Addition von Brom an organische Verbindungen.
- Lithographie : In lithographischen Verfahren wurden Kupferbromidverbindungen für den Einsatz in Mikro- und Nanofabrikationstechniken untersucht.
Die verschiedenen Anwendungen von Kupferbromid zeigen seine Bedeutung in verschiedenen Bereichen und machen es zu einer wertvollen Verbindung für industrielle und wissenschaftliche Zwecke.
Fragen:
F: Wie groß ist die Molmasse von Kupfer(II)-bromid?
A: Die Molmasse von Kupfer(II)bromid beträgt etwa 223,36 g/mol.
F: Wie lautet die Formel für Kupfer(II)bromid?
A: Die Formel für Kupfer(II)bromid lautet CuBr2.
F: Ist Kupfer(II)bromid wasserlöslich?
A: Kupfer(II)-bromid ist in Wasser nur begrenzt löslich.
F: Wofür wird Kupfer(II)bromid verwendet?
A: Kupfer(II)bromid wird als Katalysator in der organischen Synthese, Fotografie, Galvanisierung und der Halbleiterindustrie verwendet.
F: Sind Zink und Kupferbromid ein einmaliger Ersatz?
A: Ja, Zink und Kupfer(II)-bromid durchlaufen eine einzige Austauschreaktion, wobei Zinkbromid und metallisches Cu entstehen.
F: Kommt es zu einer Reaktion, wenn wässrige Lösungen von Bariumacetat und Kupfer(II)-bromid kombiniert werden?
A: Ja, es kommt zu einer Reaktion, die zur Bildung von Bariumbromid und Kupfer(II)-acetat führt.
F: Welche Ionen werden gegebenenfalls gebildet, wenn Kupfer(II)-bromid zu Wasser gegeben wird?
A: Wenn Kupfer(II)-bromid zu Wasser gegeben wird, dissoziiert es in Cu^2+-Ionen und Bromid-Ionen (Br^-).
F: Bildet CuBr2 eine ionische Bindung?
A: Ja, CuBr2 bildet eine ionische Bindung zwischen Kupfer- und Bromionen.
F: Bildet CuBr2 eine kovalente Bindung?
A: Nein, CuBr2 bildet keine kovalente Bindung.
F: Ist CuBr2 wasserlöslich?
A: CuBr2 ist in Wasser nur begrenzt löslich.
F: Was ist CuBr2?
A: CuBr2 ist die chemische Formel für Kupfer(II)bromid, eine blaugrüne kristalline Verbindung.
F: Ist CuBr2 löslich oder unlöslich?
A: CuBr2 ist in Wasser schlecht löslich.
F: Wie hoch ist der Massenanteil von Kupfer in CuBr2?
A: Der Massenanteil von Kupfer in CuBr2 beträgt etwa 47,5 %.
