Kupfer(I)-oxid ist ein rotes oder braunes Pulver mit der chemischen Formel Cu2O. Aufgrund seiner Halbleitereigenschaften wird es als Pigment, Katalysator und in Solarzellen verwendet.
| IUPAC-Name | Kupfer(I)-oxid |
| Molekularformel | Cu2O |
| CAS-Nummer | 1317-39-1 |
| Synonyme | Kupferoxid, Cuprit, Kupferoxid, Delafossit, Kupfermonoxid, Kupfersuboxid |
| InChI | InChI=1S/2Cu.O |
Molmasse von Cu2O
Die Molmasse von Cu2O beträgt 143,09 g/mol. Dieser Wert wird durch Addition der Atomgewichte von zwei Kupferatomen (63,55 g/mol x 2) und einem Sauerstoffatom (15,99 g/mol) berechnet. Die Molmasse ist eine wichtige Eigenschaft einer chemischen Verbindung, die dabei hilft, die in einer bestimmten Probe vorhandene Substanzmenge zu bestimmen. Es wird auch in stöchiometrischen Berechnungen verwendet, um die Menge der für eine chemische Reaktion erforderlichen Reaktanten zu bestimmen.
Siedepunkt von Cu2O
Cu2O hat keinen Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Beim Erhitzen zerfällt es in metallisches Kupfer und Sauerstoffgas. Die Zersetzungstemperatur von Cu2O liegt bei etwa 900°C. Daher wird Cu2O hauptsächlich als festes Material verwendet, beispielsweise als Pigment oder Halbleiter.
Schmelzpunkt von Cu2O
Der Schmelzpunkt von Cu2O beträgt 1232°C. Dieser Wert ist höher als der der meisten Metalle und Metalloxide. Cu2O hat aufgrund der starken Ionenbindung zwischen Kupfer- und Sauerstoffatomen einen hohen Schmelzpunkt. Aufgrund des hohen Schmelzpunkts eignet sich Cu2O für Hochtemperaturanwendungen wie Keramikglasuren und feuerfeste Materialien.
Dichte Cu2O g/ml
Die Dichte von Cu2O beträgt 6,01 g/cm³. Aufgrund der Anwesenheit von Sauerstoffatomen ist dieser Wert höher als die Dichte von metallischem Kupfer (8,96 g/cm³). Die hohe Dichte von Cu2O macht es für verschiedene Anwendungen nützlich, beispielsweise bei der Herstellung von elektrischen Leitern und Halbleitern.
Molekulargewicht von Cu2O
Das Molekulargewicht von Cu2O beträgt 143,09 g/mol. Dieser Wert wird durch Addition der Atomgewichte von zwei Kupferatomen und einem Sauerstoffatom berechnet. Das Molekulargewicht von Cu2O ist ein wichtiger Parameter zur Bestimmung der physikalischen und chemischen Eigenschaften der Verbindung. Es wird auch in stöchiometrischen Berechnungen verwendet, um die Menge der für eine chemische Reaktion erforderlichen Reaktanten zu bestimmen.
Cu2O-Struktur
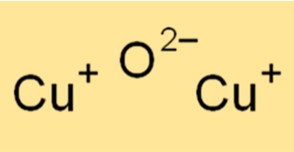
Cu2O hat eine kubische Kristallstruktur. Die Kristallstruktur von Cu2O ähnelt der von Steinsalz (NaCl). Das Cu2O-Kristallgitter besteht aus Kupferatomen, die im Verhältnis 1:1 mit Sauerstoffatomen koordiniert sind. Die Kristallstruktur von Cu2O macht es zu einem nützlichen Material für verschiedene Anwendungen, beispielsweise für die Herstellung von Halbleitern und Katalysatoren.
Kupfer(I)oxid-Formel
Die chemische Formel für Kupfer(I)-oxid lautet Cu2O. Die Formel besagt, dass Kupfer(I)-oxid aus zwei Kupferatomen und einem Sauerstoffatom besteht. Die Kupfer(I)-Oxid-Formel wird zur Bestimmung der Stöchiometrie chemischer Reaktionen unter Beteiligung von Kupfer(I)-Oxid verwendet. Es wird auch zur Berechnung der Molmasse und des Molekulargewichts der Verbindung verwendet. Die chemische Formel von Kupfer(I)-oxid ist wichtig für die Bestimmung seiner physikalischen und chemischen Eigenschaften wie Farbe, Schmelzpunkt und Dichte.
| Aussehen | Rotes oder braunes Pulver |
| Spezifisches Gewicht | 6,01 g/cm³ |
| Farbe | Rot oder braun |
| Geruch | Geruchlos |
| Molmasse | 143,09 g/Mol |
| Dichte | 6,01 g/cm³ |
| Fusionspunkt | 1232°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Unlöslich |
| Löslichkeit | Löslich in konzentrierten Säuren und Ammoniumhydroxid |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| PKa | Unzutreffend |
| PH | 8,0 – 9,0 (10 % Suspension in Wasser) |
Sicherheit und Gefahren von Kupfer(I)oxid
Cu2O ist relativ sicher in der Handhabung, muss jedoch aufgrund seiner potenziellen Gefahren mit Vorsicht gehandhabt werden. Es reizt Augen, Haut und Atemwege. Direkter Kontakt mit Cu2O-Pulver kann zu Hautreizungen führen, während das Einatmen des Pulvers zu Reizungen der Atemwege führen kann. Es ist außerdem ein brennbarer Feststoff und kann sich entzünden, wenn es Hitze oder Flammen ausgesetzt wird. Cu2O kann mit bestimmten Stoffen wie Säuren und Halogenen heftig reagieren und giftige Gase freisetzen. Beim Umgang mit Cu2O sollten angemessene Vorsichtsmaßnahmen getroffen werden, wie z. B. das Tragen von Schutzkleidung und die Vermeidung des Kontakts mit inkompatiblen Materialien.
| Gefahrensymbole | Xn: Schädlich |
| Sicherheitsbeschreibung | S22: Staub nicht einatmen. S36/37/39: Geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz tragen. S46: Bei Verschlucken sofort ärztlichen Rat einholen und Verpackung oder Etikett vorzeigen. |
| AN-Kennungen | UN3077 |
| HS-Code | 28255000 |
| Gefahrenklasse | 9 – Verschiedene gefährliche Materialien |
| Verpackungsgruppe | III |
| Toxizität | Geringe Toxizität, kann jedoch bei direktem Kontakt oder Einatmen Reizungen der Augen, der Haut und der Atemwege verursachen. |
Methoden zur Synthese von Kupfer(I)-oxid
Es gibt verschiedene Methoden zur Synthese von Kupfer(I)-oxid (Cu2O), darunter thermische Oxidation, Fällung, elektrochemische Abscheidung und chemische Reduktion.
Bei der thermischen Oxidation wird Kupfermetall in Gegenwart von Sauerstoff oder Luft auf hohe Temperaturen erhitzt, um Cu2O zu bilden. Der Prozess kann im Ofen oder durch Flammenoxidation durchgeführt werden.
Bei der Fällung handelt es sich um die Reaktion von Kupfersalzen mit einer alkalischen Lösung wie Natriumhydroxid, um Cu2O-Niederschläge zu bilden. Die Niederschläge können filtriert, gewaschen und getrocknet werden, um Cu2O-Pulver zu erhalten.
Bei der elektrochemischen Abscheidung wird eine Kupfersalzlösung mithilfe einer inerten Elektrode elektrolysiert, um Cu2O auf der Elektrodenoberfläche abzuscheiden.
Bei der chemischen Reduktion werden Kupferionen mithilfe eines Reduktionsmittels wie Natriumborhydrid oder Hydrazin in Gegenwart eines Stabilisierungsmittels wie Polyvinylpyrrolidon reduziert.
Eine andere Methode beinhaltet die thermische Zersetzung von Kupferformiat in Gegenwart eines Reduktionsmittels wie Harnstoff, um Cu2O zu bilden.
Jede Synthesemethode hat ihre Vor- und Nachteile hinsichtlich Ausbeute, Reinheit und Skalierbarkeit. Es ist wichtig, die geeignete Methode basierend auf der beabsichtigten Anwendung und den gewünschten Eigenschaften des Cu2O sorgfältig auszuwählen.
Verwendung von Kupfer(I)oxiden
Kupfer(I)-oxid hat aufgrund seiner einzigartigen Eigenschaften, darunter Halbleiterverhalten, katalytische Aktivität und antibakterielle Eigenschaften, ein breites Anwendungsspektrum. Zu den häufigsten Anwendungen von Cu2O gehören:
- Elektronik: Wird als Halbleitermaterial vom P-Typ in elektronischen Geräten wie Solarzellen, Fotodetektoren und Feldeffekttransistoren verwendet.
- Katalysator: Wird als Katalysator bei verschiedenen chemischen Reaktionen verwendet, beispielsweise bei der Oxidation von Kohlenmonoxid und der Reduktion von Stickoxiden.
- Pigment: Wird als rotes Pigment in Keramik, Gläsern und Emaille verwendet.
- Fungizid: Wird als Fungizid zur Bekämpfung von Pflanzenkrankheiten wie Knollenfäule, Falschem Mehltau und Rost eingesetzt.
- Antifouling-Mittel: Wird als Antifouling-Mittel in Schiffsanstrichen verwendet, um das Wachstum von Meeresorganismen auf Schiffen und Offshore-Strukturen zu verhindern.
- Antibakterieller Wirkstoff: Hat antibakterielle Eigenschaften. Wird in medizinischen Anwendungen wie Verbänden und antibakteriellen Beschichtungen verwendet.
- Zusatzstoff: Wird als Zusatzstoff in Tierfutter verwendet, um Kupfermangel bei Nutztieren vorzubeugen.
Die vielfältigen Einsatzmöglichkeiten von Cu2O verdeutlichen sein Potenzial als wertvolles Material in verschiedenen Branchen.
Fragen:
F: Ist Kupfer(I)-oxid im trockenen Zustand gefährlich?
A: Cu2O gilt im trockenen Zustand nicht als gefährlich, kann jedoch beim Einatmen in Pulverform die Atemwege reizen.
F: Ist Kupfer(I)oxid eine natürliche Verbindung?
A: Ja, Cu2O ist eine natürliche Verbindung, die in bestimmten Mineralien wie Cuprit und Tenorit vorkommt.
F: Was löst Kupfer(I)-oxid auf?
A: Cu2O ist in Wasser und den meisten organischen Lösungsmitteln unlöslich. Es kann in starken Säuren wie Salzsäure und in Lösungen von Ammoniak oder Kaliumcyanid gelöst werden.
F: Mit welcher chemischen Methode wird eine Kupfer(I)-Oxidschicht auf metallischem Kupfer erzeugt?
A: Eine chemische Methode zur Erzeugung einer Cu2O-Schicht auf metallischem Kupfer besteht darin, das Kupfer in eine Lösung aus Kupfersulfat und Natriumchlorid einzutauchen und das Kupfer anschließend an der Luft zu erhitzen, um die Oberfläche zu oxidieren.
F: Wie kann Kupfer aus Kupfer(I)oxid gewonnen werden?
A: Kupfer kann aus Cu2O extrahiert werden, indem die Verbindung mit Kohlenstoff oder einem anderen Reduktionsmittel erhitzt wird, um das Cu2O zu metallischem Kupfer zu reduzieren.
F: Wie viele Mol Kupfer wären nötig, um 1 Mol Cu2O herzustellen?
A: Zur Herstellung von 1 Mol Cu2O wären 2 Mol Kupfer erforderlich.
F: Was ist Cu2O?
A: Cu2O ist die chemische Formel für Kupfer(I)-oxid, ein rotes oder bräunlich-rotes Pulver, das ein Kupferoxid ist.
F: Was passiert, wenn Kupfer(I)-oxid auf einer Kupferoberfläche vorhanden ist?
A: Wenn Kupfer(I)-oxid auf einer Kupferoberfläche vorhanden ist, kann es als Schutzschicht gegen weitere Oxidation und Korrosion des Kupfermetalls wirken.
