Kohlensäure (H2CO3) entsteht, wenn sich Kohlendioxid im Wasser löst, und spielt eine entscheidende Rolle bei der Regulierung des pH-Werts der Ozeane und der Kontrolle der Gesteinsverwitterung.
| IUPAC-Name | Kohlensäure |
| Molekularformel | H2CO3 |
| CAS-Nummer | 463-79-6 |
| Synonyme | Saure Luft; Saure Luft; H2CO3; Oxidaniumylidenmethan; Saures Carbonat; Hydroxyketon; Dihydroxymethanon |
| InChI | InChI=1S/CH2O3/c2-1(3)4/h(H2,2,3,4) |
Kohlensäureformel
Die chemische Formel für Kohlensäure lautet H2CO3, was bedeutet, dass sie aus zwei Wasserstoffatomen, einem Kohlenstoffatom und drei Sauerstoffatomen besteht. Die Formel zeigt auch das Verhältnis der Atome im Molekül, das für die Bestimmung der Stöchiometrie chemischer Reaktionen mit Kohlensäure wichtig ist.
Molmasse der Kohlensäure
Die Molmasse von Kohlensäure beträgt etwa 62,03 g/mol. Es ist eine schwache Säure, die entsteht, wenn sich Kohlendioxid im Wasser löst und für die Regulierung des pH-Werts der Ozeane verantwortlich ist. Die Molmasse der Kohlensäure ist wichtig für die Berechnung der Säuremenge, die benötigt wird, um in einer Lösung einen bestimmten pH-Wert zu erreichen, und für die Bestimmung, wie viel Kohlendioxid sich in Wasser lösen kann.
Siedepunkt von Kohlensäure
Kohlensäure hat keinen genau definierten Siedepunkt, da sie vor Erreichen ihres Siedepunkts in Wasser und Kohlendioxid zerfällt. Bei Atmosphärendruck zerfällt Kohlensäure jedoch bei einer Temperatur von etwa 333 K (60 °C) in Wasser und Kohlendioxid.
Schmelzpunkt von Kohlensäure
Auch Kohlensäure hat keinen genau definierten Schmelzpunkt, da sie vor Erreichen ihres Schmelzpunktes in Wasser und Kohlendioxid zerfällt. Bei Atmosphärendruck zerfällt Kohlensäure jedoch bei einer Temperatur von etwa 273 K (-0,15 °C) in Wasser und Kohlendioxid.
Dichte der Kohlensäure g/ml
Die Dichte von Kohlensäure beträgt bei Raumtemperatur (25 °C) etwa 1,67 g/ml. Dieser Wert kann je nach Konzentration der Lösung sowie Temperatur und Druck der Umgebung variieren.
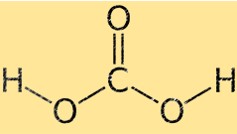
Struktur der Kohlensäure
Kohlensäure hat eine tetraedrische Molekülgeometrie mit dem Kohlenstoffatom im Zentrum und den vier umgebenden Atomen (zwei Sauerstoffatome und zwei Wasserstoffatome) an den Ecken eines Tetraeders. Die beiden Sauerstoffatome sind durch Doppelbindungen mit dem Kohlenstoffatom verbunden, während die beiden Wasserstoffatome durch Einfachbindungen verbunden sind.
Molekulargewicht von Kohlensäure
Das Molekulargewicht von Kohlensäure beträgt 62,03 g/mol. Dieser Wert wird durch Addition der Atomgewichte der Bestandteile Wasserstoff (H), Kohlenstoff (C) und Sauerstoff (O) berechnet.
| Aussehen | Farblose Flüssigkeit oder kristalliner Feststoff |
| Spezifisches Gewicht | 1,67 g/cm³ |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 62,03 g/Mol |
| Dichte | 1,67 g/ml bei Raumtemperatur (25 °C) |
| Fusionspunkt | Zersetzt sich bei ca. 273 K (-0,15 °C) |
| Siedepunkt | Zersetzt sich bei etwa 333 K (60 °C) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Vollständig löslich |
| Löslichkeit | Löslich in Wasser, Ethanol, Methanol |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 3.6 (erste Dissoziation) |
| pH-Wert | 5,6 (in 0,1 M Lösung) |
Kohlensäure Sicherheit und Gefahren
Kohlensäure (H2CO3) gilt allgemein als sicher, kann jedoch in bestimmten Situationen Gefahren mit sich bringen. Die Einwirkung von H2CO3 kann Reizungen der Augen, der Haut und der Atemwege verursachen und zu Husten, pfeifenden Atemgeräuschen und Kurzatmigkeit führen. Die Einnahme von H2CO3 kann zu Magenbeschwerden, Übelkeit und Erbrechen führen. H2CO3 ist außerdem eine schwache Säure und kann mit bestimmten Metallen wie Aluminium und Zink reagieren und brennbares Wasserstoffgas erzeugen. Bei der Handhabung oder Verwendung von H2CO3 sollten entsprechende Sicherheitsvorkehrungen getroffen werden, einschließlich des Tragens von Schutzkleidung und ausreichender Belüftung. Bei Exposition sollte sofort ein Arzt aufgesucht werden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Ungiftig |
| UN-Identifikationsnummern | Ein 1824 |
| HS-Code | 28111990 |
| Gefahrenklasse | 8 – Ätzende Stoffe |
| Verpackungsgruppe | III |
| Toxizität | Geringe Toxizität |
Methoden zur Kohlensäuresynthese
H2CO3 kann auf unterschiedliche Weise synthetisiert werden. Eine gängige Methode ist die Reaktion von Kohlendioxid (CO2) mit Wasser (H2O) in Gegenwart eines Katalysators. Bei diesem als Hydratation bezeichneten Prozess entsteht Kohlensäure:
CO2 + H2O → H2CO3
Eine andere Methode zur Synthese von Kohlensäure besteht darin, Calciumcarbonat (CaCO3) mit einer Säure wie Salzsäure (HCl) umzusetzen. Bei diesem Prozess, der als Ansäuerung bezeichnet wird, entsteht Kohlensäure:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Die Reaktion zwischen Oxalsäure und einem Carbonat wie Natriumcarbonat (Na2CO3) ermöglicht die Synthese von Kohlensäure. Bei diesem Prozess entstehen Kohlensäure und ein Salz wie Natriumoxalat:
H2C2O4 + Na2CO3 → 2H2CO3 + Na2C2O4
Das Solvay-Verfahren erzeugt Kohlensäure und Natriumbicarbonat durch die Reaktion von Natriumcarbonat (Na2CO3) mit Kohlendioxid in Gegenwart von Wasser.
2NaHCO3 + CO2 → Na2CO3 + H2CO3
Insgesamt stehen für die Synthese von Kohlensäure mehrere Methoden zur Verfügung, von denen jede ihre eigenen Vorteile und Einschränkungen hat. Die Wahl der Methode hängt von Faktoren wie der gewünschten Reinheit des Produkts, der Verfügbarkeit von Rohstoffen und dem erforderlichen Produktionsumfang ab.
Verwendungsmöglichkeiten von Kohlensäure
Kohlensäure (H2CO3) ist eine vielseitige Verbindung, die in Industrie, Medizin und Alltag vielfältige Verwendung findet. Zu den Hauptanwendungen von H2CO3 gehören:
- Kohlensäurehaltige Getränke: H2CO3 ist die Verbindung, die für die charakteristische Kohlensäure in kohlensäurehaltigen Getränken wie Limonade und Bier verantwortlich ist.
- H2CO3 puffert den pH-Wert in verschiedenen industriellen Prozessen, wie etwa der Wasseraufbereitung und der Lebensmittelverarbeitung.
- Es unterdrückt Feuer, indem es Sauerstoff verdrängt und eine Verbrennung verhindert.
- H2CO3 hemmt das Wachstum von Bakterien und Schimmel in bestimmten Arten von Lebensmitteln, um diese haltbar zu machen.
- Es wirkt als sanftes Reinigungsmittel, insbesondere zur Entfernung von mineralischen Ablagerungen.
- Medizinisches Fachpersonal verwendet H2CO3 in bestimmten Anwendungen, unter anderem zur Behandlung bestimmter Hautläsionen und zur Auslösung einer Bronchialverengung bei Lungenfunktionstests.
- Schweißer verwenden H2CO3 als Schutzgas, um Oxidation zu verhindern und sauberere Schweißnähte zu erzeugen.
Insgesamt ist Kohlensäure eine nützliche und vielseitige Verbindung, die in verschiedenen Bereichen vielfältige Anwendungsmöglichkeiten bietet.
Fragen:
F: Ist Kohlensäure eine starke Säure?
A: Kohlensäure ist eine schwache Säure, das heißt, sie dissoziiert in Wasser nur teilweise und erzeugt Wasserstoffionen (H+) und Bicarbonationen (HCO3-). Seine Säuredissoziationskonstante (Ka) ist relativ niedrig, was darauf hindeutet, dass es in Wasser nicht vollständig dissoziiert.
F: Ist Kohlendioxid sauer?
A: Kohlendioxid (CO2) ist nicht von Natur aus sauer, da es eine neutrale Verbindung ist, die im Wasser keine Wasserstoffionen (H+) erzeugt. Wenn sich CO2 jedoch in Wasser löst, kann es mit Wassermolekülen unter Bildung von Kohlensäure reagieren, einer schwachen Säure. Diese Reaktion kann dazu führen, dass der pH-Wert sinkt und die Lösung saurer wird. Obwohl CO2 selbst nicht sauer ist, kann es daher zum Säuregehalt einer Lösung beitragen, wenn es mit Wasser reagiert.
