Kaliumthiosulfat (K2S2O3) ist eine chemische Verbindung, die in der Fotografie als Reduktionsmittel und zur Neutralisierung von Chlor in Schwimmbädern verwendet wird. Es hat ein weißes kristallines Aussehen und ist wasserlöslich.
| IUPAC-Name | Kaliumthiosulfat |
| Molekularformel | K2S2O3 |
| CAS-Nummer | 10294-66-3 |
| Synonyme | Kaliumhyposulfit, Kaliumthiosulfat, Kaliumthiosulfat-Pentahydrat, Kaliumthiosulfat-Pentahydrat, Kaliumschwefelthioat, Kaliumschwefelthiosäure |
| InChI | InChI=1S/2K.H2O3S2/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Eigenschaften von Kaliumthiosulfat
Kaliumthiosulfat-Formel
Die chemische Formel für Kaliumthiosulfat (K2S2O3) gibt die Anzahl und Art der in der Verbindung vorhandenen Atome an. Die Formel besteht aus zwei Kaliumatomen, zwei Schwefelatomen und drei Sauerstoffatomen. Kaliumatome sind positiv geladen, während Schwefel- und Sauerstoffatome negativ geladen sind.
Molmasse von Kaliumthiosulfat
Die Molmasse von K2S2O3 beträgt 190,33 g/mol. Die Molmasse ist die Masse eines Mols einer Substanz und wird durch Addition der Atommassen aller Atome in der chemischen Formel berechnet. Im Fall von K2S2O3 besteht die Formel aus zwei Kaliumatomen, zwei Schwefelatomen und drei Sauerstoffatomen.
Siedepunkt von Kaliumthiosulfat
K2S2O3 hat keinen Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Wenn die Temperatur etwa 100 °C erreicht, kommt es zur Zersetzung und zur Freisetzung von Schwefeldioxid. Daher wird die Verbindung im Allgemeinen nicht für Hochtemperaturanwendungen verwendet.
Schmelzpunkt von Kaliumthiosulfat
Der Schmelzpunkt von K2S2O3 beträgt 48,3°C. Diese Temperatur ist im Vergleich zu anderen chemischen Verbindungen relativ niedrig. Beim Erhitzen auf diese Temperatur wird das feste K2S2O3 flüssig.
Dichte von Kaliumthiosulfat g/ml
Die Dichte von K2S2O3 beträgt 1,667 g/ml. Die Dichte ist ein Maß für die Massemenge, die in einem bestimmten Volumen enthalten ist. Dieser Wert bedeutet, dass ein Milliliter K2S2O3 eine Masse von 1,667 Gramm hat.
Molekulargewicht von Kaliumthiosulfat
Das Molekulargewicht von K2S2O3 beträgt 190,33 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in der Verbindung. Es wird häufig zur Umrechnung zwischen Mol und Gramm einer Substanz verwendet.
Struktur von Kaliumthiosulfat
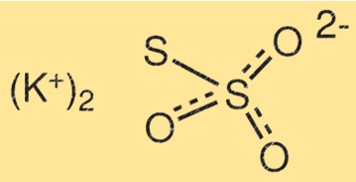
Die Struktur von K2S2O3 besteht aus zwei Kaliumatomen, zwei Schwefelatomen und drei Sauerstoffatomen. Die Schwefelatome sind durch eine Doppelbindung miteinander verbunden, während das andere Schwefelatom an eines der Sauerstoffatome gebunden ist. Die Kaliumatome sind an die übrigen Sauerstoffatome gebunden.
Löslichkeit von Kaliumthiosulfat
K2S2O3 ist in Wasser gut löslich, mit einer Löslichkeit von 432 g/L bei 20 °C. Dies macht es zu einer wirksamen Verbindung zur Wasseraufbereitung und als fotografisches Fixiermittel. Allerdings ist es in organischen Lösungsmitteln wie Ethanol oder Aceton nicht löslich.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 1.667 |
| Farbe | Farblos bis weiß |
| Geruch | Geruchlos |
| Molmasse | 190,33 g/Mol |
| Dichte | 1.667 g/ml |
| Fusionspunkt | 48,3°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr gut löslich (432 g/L bei 20°C) |
| Löslichkeit | Unlöslich in organischen Lösungsmitteln |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | 6,0 – 9,0 (5 %ige wässrige Lösung) |
Sicherheit und Gefahren von Kaliumthiosulfat
K2S2O3 gilt im Allgemeinen als sicher in der Handhabung und Verwendung, wenn die entsprechenden Vorsichtsmaßnahmen getroffen werden. Es ist jedoch wichtig, sich einiger potenzieller Gefahren bewusst zu sein, die mit dieser Verbindung verbunden sind. Die Einwirkung von K2S2O3-Staub oder -Dampf kann zu Reizungen der Augen, der Haut und der Atemwege führen. Die Einnahme der Verbindung kann auch Übelkeit, Erbrechen und Durchfall verursachen. Darüber hinaus kann der Kontakt mit der Verbindung bei manchen Menschen zu Dermatitis oder Hautsensibilisierung führen. Wie bei jeder Chemikalie ist es wichtig, beim Umgang mit K2S2O3 die entsprechenden Sicherheitsprotokolle einzuhalten, um eine Exposition zu vermeiden und das Unfallrisiko zu verringern.
| Gefahrensymbole | XI |
| Sicherheitsbeschreibung | S22 – Staub nicht einatmen. S24/25 – Kontakt mit Haut und Augen vermeiden. S37/39 – Geeignete Handschuhe und Augen-/Gesichtsschutz tragen. |
| UN-Identifikationsnummern | UN 3077 |
| HS-Code | 2832.10.00 |
| Gefahrenklasse | 9 – Verschiedene gefährliche Materialien |
| Verpackungsgruppe | III |
| Toxizität | LD50 (oral, Ratte): 2.500 mg/kg |
Methoden zur Synthese von Kaliumthiosulfat
K2S2O3 kann durch verschiedene Methoden synthetisiert werden, einschließlich der Reaktion von Schwefel mit Kaliumsulfit in Gegenwart eines Alkalimetallhydroxids.
Eine andere Methode beinhaltet die Reaktion von Kaliumhydroxid mit Schwefel und Schwefeldioxidgas. Bei dieser Reaktion entstehen K2S2O3 und Kaliumsulfat als Nebenprodukte.
Eine alternative Synthesemethode beinhaltet die Reaktion von Kaliumsulfit mit Natriumthiosulfat in einer wässrigen Lösung. Der resultierende Niederschlag kann filtriert und gewaschen werden, um reines K2S2O3 zu erhalten.
Um K2S2O3 im Labor herzustellen, kann man Kaliumhydroxid mit Schwefel reagieren lassen und dann der Mischung Schwefeldioxidgas hinzufügen. Das resultierende Produkt ist ein weißer kristalliner Feststoff, der durch Umkristallisation weiter gereinigt werden kann.
Verwendung von Kaliumthiosulfat
K2S2O3 hat mehrere wichtige Anwendungen in verschiedenen Branchen. Hier sind einige der häufigsten Anwendungen:
- Fotografie: Kaliumthiosulfat wird als Fixiermittel bei der fotografischen Entwicklung verwendet, um ungenutzte Silberhalogenide zu entfernen und das Ausbleichen von Bildern zu verhindern.
- Landwirtschaft: Kaliumthiosulfat wird als Dünger verwendet, um Pflanzen mit Schwefel und Kalium zu versorgen, die wichtige Nährstoffe für Wachstum und Entwicklung sind.
- Wasseraufbereitung: Kaliumthiosulfat wird zur Entfernung von Chlor aus Schwimmbad- und Spa-Wasser sowie zur Neutralisierung der Auswirkungen von Chlor bei der industriellen Abwasseraufbereitung verwendet.
- Analytische Chemie: Kaliumthiosulfat wird in der analytischen Chemie als Reduktionsmittel zur Bestimmung der Konzentration von Jod und anderen Oxidationsmitteln verwendet.
- Medizinische Behandlungen: Kaliumthiosulfat wurde bei einigen medizinischen Behandlungen eingesetzt, beispielsweise bei der Behandlung einer Zyanidvergiftung.
- Industrielle Anwendungen: Kaliumthiosulfat wird in verschiedenen industriellen Anwendungen verwendet, beispielsweise beim Galvanisieren, beim Gerben von Leder und bei der Ölgewinnung.
Fragen:
F: Wie stellt man fest, ob es sich bei etwas um ein Kaliumthiosulfat-Reduktionsmittel handelt?
A: K2S2O3 ist ein Reduktionsmittel, da es die Fähigkeit besitzt, Elektronen an andere Moleküle oder Ionen abzugeben und so deren Oxidationszustand zu verringern.
F: Was macht Kaliumthiosulfat zu einem Reduktionsmittel?
A: K2S2O3 hat ein Schwefelatom mit einer niedrigeren Oxidationsstufe als Sulfat, wodurch es Elektronen an andere Moleküle oder Ionen abgeben und als Reduktionsmittel wirken kann.
F: Verbrennt Kaliumthiosulfat grünes Gemüse?
A: Nein, K2S2O3 verbrennt kein Grünzeug. Es ist ein weißer kristalliner Feststoff und weist keine grüne Färbung auf.
F: Wie hoch ist die molare Löslichkeit von AgCl in 1,0 M K2S2O3?
A: Die molare Löslichkeit von AgCl in 1,0 M K2S2O3 hängt von verschiedenen Faktoren wie Temperatur und Ionenstärke ab. Ohne zusätzliche Informationen kann ein genauer Wert nicht ermittelt werden.
F: Wie hoch ist die Ladung oder Oxidationszahl von K in 2 (K2S2O3)?
A: Die Ladung oder Oxidationszahl von K in 2 (K2S2O3) beträgt +1.
F: Welche Oxidationsstufe hat S in K2S2O3?
A: Die Oxidationsstufe von S in K2S2O3 beträgt +2.
F: Wie viele Moleküle sind in 4 Mol K2S2O3 enthalten?
A: In 4 Mol K2S2O3 sind ungefähr 4 x 6,022 x 10^23 Moleküle K2S2O3 enthalten, was 2,409 x 10^24 Molekülen entspricht.
F: Wie viel sind 4 Mol K2S2O3?
A: Die Masse von 4 Mol K2S2O3 kann berechnet werden, indem die Molmasse von K2S2O3 (190,31 g/mol) mit 4 multipliziert wird, was 761,24 Gramm entspricht. Daher entsprechen 4 Mol K2S2O3 761,24 Gramm.
