Kaliumphosphat (K3PO4) ist eine Verbindung, die die Elemente Kalium und Phosphor enthält. Aufgrund seiner hohen Löslichkeit und Fähigkeit, wichtige Nährstoffe für das Pflanzenwachstum bereitzustellen, wird es häufig als Lebensmittelzusatzstoff und Düngemittel verwendet.
| Name der IUPAC | Kaliumphosphat |
| Molekularformel | K3PO4 |
| CAS-Nummer | 7778-53-2 |
| Synonyme | Trikaliumphosphat, Kaliumorthophosphat, tertiäres Kaliumphosphat, Trikaliummonophosphat, tribasisches Kaliumphosphat |
| InChI | InChI=1S/3K.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
Eigenschaften von Kaliumphosphat
Kaliumphosphat-Formel
Die chemische Formel für Kaliumphosphat lautet K3PO4. Dies weist darauf hin, dass die Verbindung in jeder Formeleinheit drei K+-Ionen und ein PO43–Ion enthält. Die Kaliumphosphatformel eignet sich zur Bestimmung der Stöchiometrie von Reaktionen, an denen die Verbindung beteiligt ist, sowie zur Bestimmung der Menge jedes Elements, das in einer bestimmten Masse der Verbindung vorhanden ist.
Molmasse von Kaliumphosphat
Die Molmasse von K3PO4 beträgt 212,27 g/mol. Sie wird durch Addition der Atommassen von Kalium, Phosphor und Sauerstoff zur Verbindung berechnet. Die Molmasse ist ein wichtiger Parameter zur Bestimmung der Stoffmenge, die in einer bestimmten Masse der Verbindung vorhanden ist. Es eignet sich auch zur Berechnung der Stöchiometrie von Reaktionen mit K3PO4.
Siedepunkt von Kaliumphosphat
Der Siedepunkt von K3PO4 liegt bei 1660°C. Dieser hohe Siedepunkt ist auf die starken Ionenbindungen zwischen den K+-Ionen und den PO43–Ionen in der Verbindung zurückzuführen. Es ist auch ein Hinweis auf die Stabilität der Verbindung bei hohen Temperaturen. Der Siedepunkt von K3PO4 ist in verschiedenen industriellen Anwendungen nützlich, beispielsweise bei der Herstellung von Keramik und Glas.
Schmelzpunkt von Kaliumphosphat
Der Schmelzpunkt von K3PO4 liegt bei 1340°C. Dies ist die Temperatur, bei der die feste Verbindung in den flüssigen Zustand übergeht. Der hohe Schmelzpunkt von K3PO4 ist auf die ionische Natur der Verbindung zurückzuführen, die eine große Energiemenge erfordert, um die Anziehungskräfte zwischen den Ionen zu überwinden. Der Schmelzpunkt von K3PO4 ist hilfreich bei der Bestimmung seiner Eignung für verschiedene Anwendungen, wie beispielsweise die Herstellung von Düngemitteln und Lebensmittelzusatzstoffen.
Dichte von Kaliumphosphat g/ml
Die Dichte von K3PO4 beträgt bei Raumtemperatur 2,564 g/ml. Die hohe Dichte der Verbindung ist auf das Vorhandensein von drei K+-Ionen und einem PO43–Ion in jeder Formeleinheit zurückzuführen. Die Dichte von K3PO4 ist hilfreich bei der Bestimmung seiner Löslichkeit und seines Verhaltens in verschiedenen industriellen Prozessen, beispielsweise bei der Herstellung von Düngemitteln und Lebensmittelzusatzstoffen.
Molekulargewicht von Kaliumphosphat
Das Molekulargewicht von K3PO4 beträgt 212,27 g/mol. Es ist die Summe der Atomgewichte aller Atome in der Verbindung. Das Molekulargewicht ist nützlich für die Berechnung der Substanzmenge, die in einer bestimmten Masse der Verbindung vorhanden ist, sowie für die Bestimmung der Stöchiometrie von Reaktionen, an denen K3PO4 beteiligt ist.
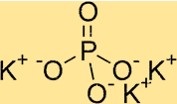
Struktur von Kaliumphosphat
K3PO4 hat eine orthorhombische Kristallstruktur. Es besteht aus einer Reihe von PO4-Tetraedern, wobei jedes Phosphation zwei Sauerstoffatome mit benachbarten Phosphationen teilt. Kaliumionen befinden sich zwischen Phosphattetraedern, umgeben von Sauerstoffatomen. Die Struktur von K3PO4 ist hilfreich für das Verständnis seiner Eigenschaften, wie etwa seiner Löslichkeit und thermischen Stabilität.
| Aussehen | weißes kristallines Pulver |
| Spezifische Dichte | 2.564 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 212,27 g/Mol |
| Dichte | 2.564 g/ml |
| Fusionspunkt | 1340°C |
| Siedepunkt | 1660°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 100 g/L (20°C) |
| Löslichkeit | Löslich in Ethanol und Aceton, unlöslich in Ether |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | pKa1 = 2,16, pKa2 = 7,21, pKa3 = 12,32 |
| pH-Wert | Der pH-Wert einer 1%igen Lösung beträgt 11,5 |
Sicherheit und Gefahren von Kaliumphosphat
Bei korrekter Handhabung gilt K3PO4 im Allgemeinen als sicher in der Anwendung. Allerdings kann es, wie jede Chemikalie, Gefahren bergen, wenn es unsachgemäß gehandhabt oder in großen Mengen eingenommen wird. Die Verbindung wird als haut-, augen- und atemwegsreizend eingestuft und kann bei Einatmen oder Verschlucken in hohen Konzentrationen schwere Verbrennungen oder Atembeschwerden verursachen. Es ist außerdem mit Säuren und Oxidationsmitteln unverträglich und kann bei Kontakt mit diesen Materialien einen Brand oder eine Explosion verursachen. Daher ist es wichtig, K3PO4 mit Vorsicht zu handhaben, geeignete Schutzausrüstung zu tragen und es an einem kühlen, trockenen und gut belüfteten Ort, fern von unverträglichen Substanzen, aufzubewahren.
| Gefahrensymbole | Xi (irritierend) |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. |
| UN-Identifikationsnummern | UN 2833 (für wasserfrei), UN 2423 (für Trihydrat) |
| HS-Code | 28352400 |
| Gefahrenklasse | 6.1 (giftig) |
| Verpackungsgruppe | III |
| Toxizität | LD50 (oral, Ratte): 2.340 mg/kg; LC50 (Inhalation, Ratte): 50 mg/L |
Methoden zur Synthese von Kaliumphosphat (K3PO4)
Es gibt verschiedene Methoden zur Synthese von K3PO4, darunter die Reaktion von Phosphorsäure (H3PO4) mit Kaliumhydroxid (KOH) oder die thermische Zersetzung von KH2PO4.
Eine Methode besteht darin, äquimolare Mengen KOH und H3PO4 in Wasser bei einer Temperatur von etwa 60 bis 80 °C zur Reaktion zu bringen. Das Verfahren umfasst das Eindampfen der resultierenden Mischung und das Erhitzen des festen Rückstands auf etwa 300 °C, um K3PO4 zu erzeugen.
Eine andere Methode besteht darin, KH2PO4 mit KOH bei hoher Temperatur (über 400 °C) zu reagieren, um K3PO4 und Wasser zu erzeugen. Ein spezieller Ofen kann diesen Prozess namens thermische Zersetzung durchführen.
Die Reaktion von Phosphorsäure mit Kaliumcarbonat (K2CO3) und die Reaktion von Kaliumoxid (K2O) mit Phosphorpentoxid (P2O5) sind weitere Methoden zur Herstellung von K3PO4.
Verwendung von Kaliumphosphat
K3PO4 hat mehrere praktische Einsatzmöglichkeiten in einer Reihe von Branchen, darunter:
- Düngemittel: Aufgrund seines hohen Phosphorgehalts wird es häufig als Düngemittel verwendet. Landwirte fügen es häufig dem Boden hinzu, um Pflanzen mit wichtigen Nährstoffen zu versorgen.
- Lebensmittelindustrie: Wird als Lebensmittelzusatzstoff verwendet, um den Säuregehalt zu regulieren, Verfärbungen vorzubeugen und die Textur zu verbessern.
- Puffermittel: Verschiedene Laboranwendungen nutzen es als wirksames Puffermittel, darunter pH-Kalibrierungspufferlösungen und biologische Forschung.
- Reinigungsmittel: Wird aufgrund seiner Fähigkeit, Wasser zu enthärten und die Bildung von Mineralablagerungen zu verhindern, bei der Herstellung von Reinigungsmitteln und Reinigungsmitteln verwendet.
- Medizin: Wird als Nahrungsergänzungsmittel zur Behandlung bestimmter Erkrankungen wie niedrigem Phosphatspiegel im Blut verwendet.
- Wasseraufbereitung: Wird bei der Wasseraufbereitung verwendet, um die Bildung von Ablagerungen und Korrosion in Rohren und Geräten zu verhindern.
- Flammhemmend: Wird aufgrund seiner Fähigkeit, Wasserdampf freizusetzen und die Ausbreitung von Flammen zu verhindern, als Flammschutzmittel in verschiedenen Materialien, einschließlich Textilien und Kunststoffen, verwendet.
Fragen:
F: Ist Kaliumphosphat wasserlöslich?
A: Ja, K3PO4 ist wasserlöslich.
F: Wie viele Kaliumionen werden benötigt, um ein Phosphation zu binden?
A: Drei Kaliumionen sind erforderlich, um an ein Phosphation zu binden und K3PO4 zu bilden.
F: Welcher Niederschlag entsteht, wenn wässrige Lösungen von Calciumbromid und Kaliumphosphat gemischt werden?
A: Wenn wässrige Lösungen von Calciumbromid und K3PO4 gemischt werden, bildet sich ein Niederschlag aus Calciumphosphat (Ca3(PO4)2).
F: Ist k3po4 wasserlöslich?
A: Ja, K3PO4 ist wasserlöslich.
F: Ist k3po4 löslich?
A: Ja, K3PO4 ist wasserlöslich.
F: Welche Produkte entstehen beim Mischen wässriger Lösungen von Ni(C2H3O2)2 (wässrig) und K3PO4 (wässrig)?
A: Wenn wässrige Lösungen von Ni(C2H3O2)2 und K3PO4 gemischt werden, bildet sich ein Niederschlag aus Nickel(II)phosphat (Ni3(PO4)2), ebenso wie wässrige Lösungen von Kaliumacetat (KCH3COO) und Essigsäure (CH3COOH).
F: Welches Element erhöht bei dieser Reaktion seine Oxidationszahl? 3KOH + H3PO4 → K3PO4 + 3H2O
A: Das Element Phosphor erhöht seine Oxidationszahl von +5 in H3PO4 auf +5 in K3PO4.
F: Was ist K3PO4?
A: K3PO4 ist die chemische Formel für Kaliumphosphat, eine Verbindung, die in verschiedenen Anwendungen wie Düngemitteln, Lebensmittelzusatzstoffen und Reinigungsmitteln verwendet wird.
