Kaliumperoxid (K2O2) ist eine Verbindung aus Kalium und Sauerstoff. Es wird häufig als starkes Oxidationsmittel in der Industrie und in Labors eingesetzt, um verschiedene chemische Reaktionen zu erleichtern.
| IUPAC-Name | Kaliumperoxyoxydanid |
| Molekularformel | K2O2 |
| CAS-Nummer | 17014-71-0 |
| Synonyme | Kaliumsuperoxid; Dikaliumdioxid; Kaliumdioxid; Perkaliumoxid |
| InChI | InChI=1S/2K.O2/c;;1-2/q2*+1;-2 |
Eigenschaften von Kaliumperoxid
Kaliumperoxid-Formel
Die chemische Formel für Kaliumperoxid lautet K2O2. Diese Formel gibt die Anzahl und Art der im Molekül vorhandenen Atome an. Die Formel ist wichtig, um den Stoff zu identifizieren und seine chemischen Eigenschaften zu verstehen.
Molmasse von Kaliumperoxid
Die Molmasse von K2O2 beträgt 110,2 g/mol. Das bedeutet, dass ein Mol K2O2 110,2 Gramm wiegt. Die Molmasse ist eine wichtige Eigenschaft eines Stoffes, da sie es Ihnen ermöglicht, die Menge eines Stoffes zu berechnen, die in einer bestimmten Masse oder einem bestimmten Volumen vorhanden ist.
Siedepunkt von Kaliumperoxid
K2O2 hat keinen bestimmten Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Bei hohen Temperaturen zerfällt K2O2 in Kaliumoxid und Sauerstoffgas. Daher wird es im Allgemeinen nicht in Hochtemperaturanwendungen verwendet.
Schmelzpunkt von Kaliumperoxid
Der Schmelzpunkt von K2O2 liegt bei 655°C. Dieser hohe Schmelzpunkt macht es zu einem geeigneten Oxidationsmittel bei Hochtemperaturreaktionen. Es ist jedoch wichtig zu beachten, dass es sich zersetzen kann, bevor es seinen Schmelzpunkt erreicht, wenn es hohen Temperaturen oder Feuchtigkeit ausgesetzt wird.
Dichte von Kaliumperoxid g/ml
Die Dichte von K2O2 beträgt 2,08 g/ml. Diese hohe Dichte macht es zu einem dichten Feststoff, der im Wasser versinkt. Die Dichte von K2O2 ist auch wichtig für die Bestimmung seiner Löslichkeit in verschiedenen Lösungsmitteln.
Molekulargewicht von Kaliumperoxid
Das Molekulargewicht von K2O2 beträgt 110,2 g/mol. Dieser Wert ist die Summe der Atomgewichte aller im Molekül vorhandenen Atome. Das Molekulargewicht ist eine wichtige Eigenschaft zur Berechnung verschiedener Eigenschaften einer Substanz, einschließlich ihrer Molmasse und Dichte.
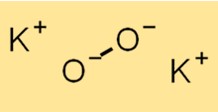
Struktur von Kaliumperoxid
Die Struktur von K2O2 besteht aus einem K+-Kation und einem O2^2–Anion. Das O2^2-Anion besteht aus zwei kovalent miteinander verbundenen Sauerstoffatomen. Die Struktur von K2O2 ist für das Verständnis seiner chemischen Eigenschaften und Reaktivität von entscheidender Bedeutung.
| Aussehen | Weißer bis hellgelber Feststoff |
| Spezifisches Gewicht | 2.08 |
| Farbe | Weiß bis hellgelb |
| Geruch | Geruchlos |
| Molmasse | 110,2 g/Mol |
| Dichte | 2,08 g/ml |
| Fusionspunkt | 655°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert mit Wasser |
| Löslichkeit | Unlöslich in organischen Lösungsmitteln |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Kaliumperoxid
K2O2 birgt aufgrund seiner stark oxidierenden Eigenschaften mehrere Sicherheitsrisiken. Es kann heftig mit Wasser oder Feuchtigkeit reagieren, dabei Sauerstoffgas freisetzen und Wärme erzeugen. Diese Reaktion kann bei unsachgemäßer Handhabung möglicherweise einen Brand oder eine Explosion verursachen. Darüber hinaus kann es bei Kontakt zu Haut- und Augenreizungen kommen, und das Einatmen des Staubs kann zu Atemwegserkrankungen führen. Es ist wichtig, vorsichtig mit K2O2 umzugehen, geeignete persönliche Schutzausrüstung zu tragen und es an einem kühlen, trockenen Ort, entfernt von Wärmequellen und inkompatiblen Materialien, aufzubewahren. Im Falle einer versehentlichen Exposition suchen Sie sofort einen Arzt auf.
| Gefahrensymbole | Oxidationsmittel |
| Sicherheitsbeschreibung | Nicht Wasser aussetzen. Schutzhandschuhe und Augen-/Gesichtsschutz tragen. An einem kühlen, trockenen Ort, fern von Wärmequellen und unverträglichen Materialien aufbewahren. |
| UN-Identifikationsnummern | UN1504 |
| HS-Code | 2829.90.90 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Kann Haut- und Augenreizungen verursachen. Das Einatmen von Staub kann Atemprobleme verursachen. |
Methoden zur Kaliumperoxid-Synthese
Es gibt verschiedene Methoden zur Synthese von K2O2, darunter die Reaktion von Kaliumhydroxid mit Wasserstoffperoxid , die Reaktion von Kaliumhydroxid mit Bariumperoxid und die thermische Zersetzung von Kaliumsuperoxid.
Bei der ersten Methode wird einer Wasserstoffperoxidlösung unter Rühren langsam Kaliumhydroxid zugesetzt, bis sich ein weißer K2O2-Niederschlag bildet. Der Prozess umfasst das Filtrieren der Mischung und das Waschen des Feststoffs mit kaltem Wasser, um Verunreinigungen zu entfernen.
Bei der zweiten Methode wird eine Bariumperoxid-Suspension gerührt und gleichzeitig eine Kaliumhydroxidlösung hinzugefügt. Filtrieren Sie die Mischung und verdampfen Sie das Filtrat zur Trockne. Erhitzen Sie dann den resultierenden Feststoff auf eine hohe Temperatur, um das verbleibende Bariumperoxid zu zersetzen und K2O2 zu bilden.
Bei der dritten Methode wird Kaliumsuperoxid auf eine hohe Temperatur erhitzt, wodurch es in K2O2 und Sauerstoffgas zerfällt.
Verwendung von Kaliumperoxid
Aufgrund seiner oxidierenden Eigenschaften findet K2O2 in verschiedenen Branchen vielfältige Verwendungsmöglichkeiten. Zu seinen Verwendungsmöglichkeiten gehören:
- Bleichmittel: Wird als Bleichmittel für Textilien und Papierprodukte sowie für Haar- und Zahnaufhellungsprodukte verwendet.
- Sauerstoffquelle: Wird als Sauerstoffquelle in geschlossenen Systemen verwendet, beispielsweise in U-Booten, wo es beim Mischen mit Wasser Sauerstoff freisetzen kann.
- Polymerisation: Wird bei der Polymerisation bestimmter Monomere zur Herstellung von Polymeren verwendet, beispielsweise bei der Synthese von Polystyrol.
- Bodensanierung: Wird zur Bodensanierung verwendet, um organische Verunreinigungen wie Ölverschmutzungen zu entfernen.
- Analytische Chemie: Wird in der analytischen Chemie als Oxidationsmittel zur Bestimmung des Vorhandenseins bestimmter Verbindungen verwendet.
- Raketentreibstoff: Wird aufgrund seiner Fähigkeit, Sauerstoff freizusetzen, als Oxidationsmittel in Raketentreibstoff verwendet.
- Chemische Synthese: Wird bei der Synthese verschiedener organischer und anorganischer Verbindungen verwendet, beispielsweise bei der Synthese von Kaliumpermanganat.
Fragen:
F: Was ist besser, Wasserstoffperoxid oder Kaliumhydroxid?
A: Das hängt vom Verwendungszweck ab. Wasserstoffperoxid ist ein starkes Oxidationsmittel und wird häufig als Desinfektionsmittel, Bleichmittel sowie Haar- und Zahnaufheller verwendet. Kaliumhydroxid hingegen ist eine starke Base und wird häufig bei der Herstellung von Seifen und Waschmitteln sowie bei der Herstellung von Biodiesel aus Pflanzenölen verwendet.
F: Wie lauten die chemischen Formeln für Kaliumsuperoxid, Kaliumperoxid und Kaliumoxid?
A: Die chemischen Formeln lauten K2O2 für Kaliumsuperoxid, K2O2 für Kaliumperoxid und K2O für Kaliumoxid.
F: Was entsteht, wenn Wasserstoffperoxid mit Kaliumjodid und Jodat reagiert?
A: Wenn Wasserstoffperoxid mit Kaliumjodid und Jodat reagiert, entsteht Jod gemäß der folgenden Reaktion: H2O2 + KI + KIO3 → I2 + K2O + H2O.
F: Wie hoch ist die Oxidationszahl des Sauerstoffatoms in K2O2?
A: Die Oxidationszahl des Sauerstoffatoms in K2O2 beträgt -1.
F: Wie hoch ist die Oxidationszahl von K in K2O2?
A: Die Oxidationszahl von K in K2O2 beträgt +1.
