Kaliumpermanganat (KMnO4) ist eine violette kristalline Verbindung, die für verschiedene Zwecke verwendet wird, beispielsweise zur Wasserdesinfektion, zur Behandlung von Hauterkrankungen und als Laborreagenz. Es kann auch als starkes Oxidationsmittel verwendet werden.
| IUPAC-Name | Kaliumpermanganat |
| Molekularformel | KMnO4 |
| CAS-Nummer | 7722-64-7 |
| Synonyme | Kalipermanganat, Kondykristalle, Chamäleonmineral, Hypermangan, Kalium hypermanganicum |
| InChI | InChI=1S/K.Mn.4O/q+1;;;;-1 |
Eigenschaften von Kaliumpermanganat
Kaliumpermanganat-Formel
Die chemische Formel für Kaliumpermanganat lautet KMnO4. Es besteht aus einem Kaliumion (K+), einem Manganion (MnO4^-) und vier Sauerstoffatomen (O). Die Formel gibt die Art und Anzahl der Atome an, aus denen die Verbindung besteht. Es wird zum Schreiben chemischer Gleichungen und zum Berechnen der Masse und Anzahl der in einer bestimmten Substanzmenge vorhandenen Atome verwendet.
Molmasse von Kaliumpermanganat
KMnO4 hat eine Molmasse von 158.034 g/mol. Das bedeutet, dass ein Mol KMnO4, was 6,022 x 10^23 Molekülen entspricht, eine Masse von 158,034 Gramm hat. Die Molmasse einer Verbindung wird durch Addition der Atommassen aller in der Verbindung vorhandenen Elemente berechnet. Bei KMnO4 errechnet sich die Molmasse durch Addition der Atommassen von Kalium, Mangan und Sauerstoff.
Siedepunkt von Kaliumpermanganat
KMnO4 hat keinen definierten Siedepunkt, da es sich vor Erreichen seines Siedepunkts zersetzt. Bei Atmosphärendruck beginnt sich KMnO4 bei etwa 240 °C zu zersetzen. Beim Erhitzen setzt es zunächst Sauerstoff frei und bildet Kaliummanganat, das dann in Kaliumoxid und Manganoxid zerfällt.
Schmelzpunkt von Kaliumpermanganat
KMnO4 hat einen hohen Schmelzpunkt von 240°C. Das bedeutet, dass KMnO4 bei Temperaturen unter 240 °C in festem Zustand vorliegt. Beim Erhitzen durchläuft KMnO4 eine Reihe chemischer Veränderungen, darunter die Freisetzung von Sauerstoff und die Bildung verschiedener Manganoxide.
Dichte von Kaliumpermanganat g/ml
Die Dichte von KMnO4 beträgt bei Raumtemperatur 2,703 g/ml. Das bedeutet, dass ein Milliliter KMnO4 2,703 Gramm wiegt. Die Dichte eines Stoffes ist das Verhältnis seiner Masse zu seinem Volumen. Im Fall von KMnO4 eignet es sich aufgrund seiner hohen Dichte gut zur Trennung von anderen Stoffen durch Filtration.
Molekulargewicht von Kaliumpermanganat
Das Molekulargewicht von KMnO4 beträgt 158,034 g/mol. Dieser Wert stellt die durchschnittliche Masse eines KMnO4-Moleküls dar. Sie wird durch Addition der Atommassen von Kalium, Mangan und Sauerstoff berechnet, aus denen die Verbindung besteht.
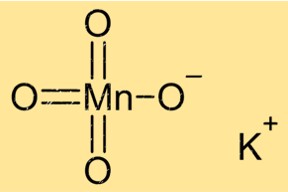
Struktur von Kaliumpermanganat
KMnO4 hat eine Kristallstruktur mit einem monoklinen Kristallsystem. Seine Kristalle haben eine violette Farbe und eine prismatische Form. Die Verbindung hat eine oktaedrische Koordinationsgeometrie mit sechs Sauerstoffatomen, die das zentrale Manganatom umgeben. Kaliumionen befinden sich zwischen Schichten aus Mangan- und Sauerstoffatomen.
| Aussehen | Dunkelvioletter kristalliner Feststoff |
| Spezifisches Gewicht | 2.703 g/cm³ |
| Farbe | Dunkelviolett |
| Geruch | Geruchlos |
| Molmasse | 158.034 g/Mol |
| Dichte | 2.703 g/cm³ |
| Fusionspunkt | 240°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 6,38 g/L bei 20°C |
| Löslichkeit | Löslich in Wasser, Ethanol, Aceton |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 2.17 |
| pH-Wert | 7,2 – 8,9 (1%ige Lösung) |
Sicherheit und Gefahren von Kaliumpermanganat
KMnO4 kann bei unsachgemäßer Handhabung gefährlich sein. Es ist ein starkes Oxidationsmittel, das heftig mit Reduktionsmitteln, organischen Verbindungen und anderen Chemikalien reagieren kann. Es kann Haut- und Augenreizungen hervorrufen und beim Verschlucken oder Einatmen gesundheitsschädlich sein. Die Verbindung kann auch Haut und Kleidung verfärben. Beim Umgang mit KMnO4 sollten entsprechende Sicherheitsvorkehrungen getroffen werden, einschließlich des Tragens von Schutzkleidung, Brille und Handschuhen. Es sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von inkompatiblen Materialien, gelagert werden. Bei Exposition oder Verschlucken sofort einen Arzt aufsuchen.
| Gefahrensymbole | O, Xn |
| Sicherheitsbeschreibung | S22, S26, S36/37/39, S45 |
| UN-Identifikationsnummern | UN 1490 |
| HS-Code | 28416100 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Giftig bei Verschlucken oder Einatmen. Kann Haut- und Augenreizungen verursachen. |
Methoden zur Synthese von Kaliumpermanganat
Verschiedene Methoden können KMnO4 synthetisieren.
Eine Methode besteht darin, Mangandioxid mit Kaliumhydroxid und einem Oxidationsmittel wie Chlor oder Wasserstoffperoxid umzusetzen.
Eine andere Methode besteht darin, Kaliummanganat mit Chlorgas umzusetzen.
Eine weitere Methode beinhaltet die Reaktion von Kaliumhydroxid mit Mangandioxid und die anschließende Oxidation der resultierenden Mischung mit einem Oxidationsmittel.
Der Syntheseprozess umfasst normalerweise das Erhitzen der Reaktanten auf eine bestimmte Temperatur und das Halten dieser Temperatur für eine bestimmte Zeit. Der Prozess besteht darin, die resultierende Mischung zu filtrieren und durch Kristallisation KMnO4 zu gewinnen.
Verwendung von Kaliumpermanganat
KMnO4 findet aufgrund seiner starken oxidierenden Eigenschaften vielfältige Verwendungsmöglichkeiten in verschiedenen Branchen. Hier sind einige häufige Anwendungen von KMnO4:
- Wasseraufbereitung: Wird zur Aufbereitung von Wasser für kommunale und industrielle Zwecke verwendet, da Verunreinigungen entfernt und unangenehme Gerüche beseitigt werden können.
- Medizinische Anwendungen: topisch zur Behandlung von Hauterkrankungen (Ekzeme, Dermatitis und Pilzinfektionen) angewendet.
- Verwendung im Labor: Wird als Oxidationsmittel in verschiedenen Laborexperimenten und als Färbemittel in der Biologie zur Hervorhebung von Zellen und Geweben verwendet.
- Landwirtschaft: Wird als Fungizid und Bakterizid zum Schutz von Nutzpflanzen vor schädlichen Schädlingen und Krankheiten eingesetzt.
- Chemie: Wird in der analytischen Chemie zur Bestimmung der Konzentration bestimmter Chemikalien und in der organischen Chemie als Reagens bei chemischen Reaktionen verwendet.
- Brandbekämpfung: Wird als Flammschutzmittel und zum Löschen bestimmter Arten von Bränden verwendet.
- Industrielle Anwendungen: Wird bei der Herstellung von Chemikalien, Textilien und Batterien verwendet.
Fragen:
F: Welches Gas wird beim Abbau von Kaliumpermanganat freigesetzt?
A: Beim Abbau von KMnO4 wird Sauerstoffgas (O2) freigesetzt.
F: Was ist Kaliumpermanganat?
A: Kaliumpermanganat ist ein starkes Oxidationsmittel mit der chemischen Formel KMnO4.
F: Wie lautet die chemische Formel von Kaliumpermanganat?
A: Die chemische Formel für Kaliumpermanganat lautet KMnO4.
F: Wo kann man Kaliumpermanganatkristalle kaufen?
A: KMnO4-Kristalle können bei Chemielieferanten, Laborbedarfsunternehmen und Online-Händlern erworben werden.
F: Was ist KMnO4?
A: KMnO4 ist die chemische Formel für Kaliumpermanganat.
F: Wie hoch ist die Oxidationszahl von Mangan in KMnO4?
A: Die Oxidationszahl von Mangan in KMnO4 beträgt +7.
F: Wie hoch ist die Oxidationszahl von Sauerstoff in KMnO4?
A: Die Oxidationszahl von Sauerstoff in KMnO4 beträgt -2.
F: Wie viele Mol sind in 25,0 Gramm KMnO4 enthalten?
A: Um die Anzahl der Mol in 25,0 Gramm KMnO4 zu berechnen, müssen wir die angegebene Masse durch die Molmasse von KMnO4 dividieren. Die Molmasse von KMnO4 beträgt 158,034 g/mol. Daher sind in 25,0 Gramm etwa 0,158 Mol KMnO4 enthalten.
