Kaliumnitrat (KNO3) ist ein weißes kristallines Salz, das häufig in Düngemitteln, zur Lebensmittelkonservierung und in Feuerwerkskörpern verwendet wird. Es ist auch ein wichtiger Bestandteil einiger Zahnpasten für empfindliche Zähne.
| IUPAC-Name | Kaliumnitrat |
| Molekularformel | KNO3 |
| CAS-Nummer | 7757-79-1 |
| Synonyme | Salpeter; Kalinitrat; Salpeter; Salpeter; E252; Chinesischer Salpeter; Salpetersäure, Kaliumsalz; Nitras von Kalii |
| InChI | InChI=1S/K.NO3/c;2-1(3)4/q+1;-1 |
Eigenschaften von Kaliumnitrat
Kaliumnitrat-Formel
Die chemische Formel für Kaliumnitrat lautet KNO3. Diese Formel zeigt, dass die Verbindung aus einem Kaliumion, einem Nitration und drei Sauerstoffionen besteht. Die Formel eignet sich zur Berechnung der Menge an Kaliumnitrat, die für eine Reaktion benötigt wird, sowie zur Identifizierung der in der Verbindung vorhandenen Elemente und Ionen.
Molmasse von Kaliumnitrat
KNO3 hat eine Molmasse von 101,1 g/mol. Die Molmasse ist die Masse eines Mols einer Substanz und wird durch Addition der Atommassen aller Atome in der Verbindung berechnet. Im Fall von KNO3 errechnet sich die Molmasse durch Addition der Atommasse eines Kaliumatoms, eines Stickstoffatoms und dreier Sauerstoffatome. Dieser Wert ist nützlich, um die Menge an KNO3 zu bestimmen, die in einer Reaktion benötigt wird, und um andere Eigenschaften wie die Konzentration zu berechnen.
Siedepunkt von Kaliumnitrat
KNO3 hat einen relativ hohen Siedepunkt von 1,336 °C (2,437 °F). Das bedeutet, dass viel Energie benötigt wird, um die Bindungen zwischen den Atomen der Verbindung aufzubrechen und sie von einer Flüssigkeit in ein Gas umzuwandeln. Diese Eigenschaft macht KNO3 nützlich für Anwendungen, die Hochtemperaturreaktionen erfordern, beispielsweise bei der Herstellung von Feuerwerkskörpern.
Schmelzpunkt von Kaliumnitrat
KNO3 hat einen Schmelzpunkt von 334 °C (633 °F). Das bedeutet, dass sich KNO3 bei Temperaturen über 334 °C vom festen in den flüssigen Zustand umwandelt. Diese Eigenschaft macht KNO3 in Anwendungen wie der Glasherstellung nützlich, wo es als Flussmittel zur Senkung des Schmelzpunkts von Siliziumdioxid verwendet wird.
Dichte von Kaliumnitrat g/ml
Die Dichte von KNO3 beträgt bei Raumtemperatur 2,109 g/ml. Die Dichte ist ein Maß für die Masse pro Volumeneinheit eines Stoffes. Die Dichte von KNO3 ist wichtig für Anwendungen wie die Düngemittelproduktion, wo es als Stickstoff- und Kaliumquelle verwendet wird. Die Dichte ist auch nützlich, um die Menge an KNO3 zu bestimmen, die in einem bestimmten Lösungsvolumen benötigt wird.
Molekulargewicht von Kaliumnitrat
Das Molekulargewicht von KNO3 beträgt 101,1 g/mol. Dieser Wert wird durch Addition der Atomgewichte aller Atome in der Verbindung berechnet. Das Molekulargewicht ist nützlich, um andere Eigenschaften von KNO3 zu berechnen, beispielsweise die Menge an KNO3, die für eine Reaktion benötigt wird, oder die Konzentration einer Lösung.
Struktur von Kaliumnitrat
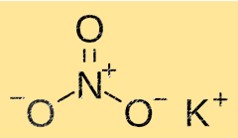
KNO3 hat eine Kristallstruktur, die aus Kalium-, Nitrat- und Sauerstoffionen besteht. Kaliumionen sind von sechs Nitrationen umgeben, während Nitrationen von sechs Kaliumionen umgeben sind. Diese Struktur verleiht KNO3 seine charakteristischen Eigenschaften wie Löslichkeit, Schmelzpunkt und Dichte.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 2,109 g/cm³ bei 20°C |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 101,1032 g/Mol |
| Dichte | 2,109 g/cm³ |
| Fusionspunkt | 334°C (633°F) |
| Siedepunkt | 400 °C (752 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 133 g/L bei 20°C |
| Löslichkeit | Löslich in Glycerin, Ammoniak und Wasser |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | 4,75 |
| pH-Wert | 6,9 – 7,3 |
Sicherheit und Gefahren von Kaliumnitrat
KNO3 ist bei korrekter Handhabung relativ sicher, kann jedoch bei unsachgemäßer Handhabung Gefahren bergen. Es wird als Oxidationsmittel eingestuft, was bedeutet, dass es die Verbrennung anderer Materialien fördern kann. KNO3 kann außerdem Augen, Haut und Atemwege reizen und bei Einnahme oder Einatmen großer Mengen giftig sein. Beim Umgang mit KNO3 ist es wichtig, Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske zu tragen und es an einem kühlen, trockenen Ort, entfernt von brennbaren Materialien, aufzubewahren. Um eine Kontamination der Umwelt zu vermeiden, sollten auch ordnungsgemäße Entsorgungsmethoden befolgt werden.
| Gefahrensymbole | O, Xn |
| Sicherheitsbeschreibung | Von Hitze/Funken/offener Flamme/heißen Oberflächen fernhalten. Schutzhandschuhe/Augenschutz/Gesichtsschutz tragen. BEI VERSCHLUCKEN: Bei Unwohlsein GIFTINFORMATIONSZENTRUM/Arzt anrufen. Spülen Sie Ihren Mund aus. KEIN Erbrechen herbeiführen. BEI EINATMEN: Das Opfer an die frische Luft bringen und in einer Position ruhigstellen, die das Atmen erleichtert. GIFTINFORMATIONSZENTRUM/Arzt anrufen. |
| UN-Identifikationsnummern | 1486 |
| HS-Code | 2834.21.00 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | III |
| Toxizität | Kann beim Einatmen zu Reizungen der Atemwege, Husten und Atemnot führen. Kann Augen- und Hautreizungen verursachen. Beim Verschlucken kann es zu Bauchschmerzen, Übelkeit, Erbrechen und Durchfall kommen. Kann bei Verschlucken oder Einatmen großer Mengen giftig sein. |
Methoden zur Kaliumnitrat-Synthese
Mehrere Methoden können KNO3 synthetisieren.
Eine gängige Methode ist die Reaktion zwischen Kaliumhydroxid und Salpetersäure . Das Reaktionsgefäß vermischt die beiden Substanzen und erhitzt sie auf eine hohe Temperatur, normalerweise etwa 80 °C. Danach kühlt die Mischung ab und der Filtrationsprozess gewinnt das feste KNO3 zurück.
Eine andere Methode ist die Reaktion zwischen Kaliumchlorid und Natriumnitrat. Eine Person mischt die beiden Substanzen in einem Reaktionsgefäß und erhitzt sie auf eine hohe Temperatur, normalerweise etwa 600 °C.
Die resultierende Mischung schmilzt und verfestigt sich dann und bildet KNO3-Kristalle.
Eine dritte Methode beinhaltet die Oxidation von Ammoniak durch Salpetersäure in Gegenwart eines Katalysators. Diese Methode ist aufwändiger und wird in der Regel im industriellen Maßstab eingesetzt.
KNO3 kann aus natürlichen Quellen wie Höhlen und unterirdischen Lagerstätten gewonnen werden. Diese Methode ist jedoch aufgrund der geringen Ausbeuten und der im extrahierten KNO3 enthaltenen Verunreinigungen weniger verbreitet.
Verwendung von Kaliumnitrat
Aufgrund seiner chemischen Eigenschaften findet KNO3 vielfältige Einsatzmöglichkeiten in verschiedenen Branchen. Hier sind einige häufige Anwendungen von KNO3:
- Dünger – Wird aufgrund seines hohen Stickstoff- und Kaliumgehalts als Dünger verwendet. Es ist besonders nützlich für Kulturpflanzen, die einen hohen Kaliumbedarf haben, wie Obst, Gemüse und Tabak.
- Lebensmittelkonservierung – Wird auch als Lebensmittelkonservierungsmittel verwendet, insbesondere in Wurstwaren. Es hemmt das Wachstum von Bakterien und verhindert den Verderb, wodurch die Haltbarkeit des Produkts verlängert wird.
- Pyrotechnik – Sie ist ein Schlüsselelement bei der Herstellung von Feuerwerkskörpern und anderen pyrotechnischen Geräten. Es wirkt als Oxidationsmittel und erzeugt Sauerstoff, der die Verbrennung anderer Materialien antreibt.
- Zahnpasta – Wird einigen Zahnpasten zugesetzt, um die Zahnempfindlichkeit zu verringern. Es blockiert die Übertragung von Schmerzsignalen vom Zahnnerv zum Gehirn.
- Medizinische Verwendung – Wird wegen seiner harntreibenden und schleimlösenden Eigenschaften medizinisch verwendet. Es behandelt auch Angina pectoris und Bluthochdruck.
- Industrielle Anwendungen – Wird auch in verschiedenen industriellen Anwendungen verwendet, z. B. in der Glas-, Keramik- und Farbstoffproduktion.
Fragen:
F: Ist Kaliumnitrat wasserlöslich?
A: Ja, KNO3 ist gut wasserlöslich. Bei Raumtemperatur können 100 Gramm Wasser etwa 37 Gramm KNO3 lösen.
F: Wofür wird Kaliumnitrat verwendet?
A: KNO3 wird für verschiedene Zwecke verwendet, unter anderem als Düngemittel, Lebensmittelkonservierungsmittel, pyrotechnisches Oxidationsmittel, Zahnpastabestandteil und als Bestandteil bei der Herstellung von Glas, Keramik und Farbstoffen.
F: Was ist Kaliumnitrat?
A: Kaliumnitrat, auch Salpeter genannt, ist eine chemische Verbindung mit der Formel KNO3. Es ist ein ionisches Salz, das aus Kaliumionen (K+) und Nitrationen (NO3-) besteht.
F: Was neutralisiert Kaliumnitrat?
A: Calcium- und Magnesiumionen können den schädlichen Auswirkungen von übermäßigem KNO3 in Pflanzen entgegenwirken. Beim Menschen gibt es kein bekanntes Gegenmittel gegen eine KNO3-Vergiftung und eine Behandlung ist sehr hilfreich.
F: Ist kno3 wasserlöslich?
A: Ja, KNO3 ist gut wasserlöslich.
F: Was ist ein Produkt der Wasserelektrolyse, das eine geringe Konzentration an kno3 enthält?
A: Die Produkte der Wasserelektrolyse, die eine geringe Konzentration an KNO3 enthalten, sind Wasserstoffgas (H2) und Sauerstoffgas (O2).
F: Was ist kno3?
A: KNO3 ist die chemische Formel für Kaliumnitrat, auch bekannt als Salpeter.
F: Welchen Oxidationszustand hat ein einzelnes Stickstoffatom in kno3?
A: In KNO3 beträgt die Oxidationsstufe jedes Stickstoffatoms +5.
F: Ist kno3 eine Säure oder eine Base?
A: KNO3 ist weder eine Säure noch eine Base. Es ist ein Salz, bestehend aus einem Kation (K+) und einem Anion (NO3-).
