Kaliummetabisulfit (K2S2O5), auch bekannt als Kaliumpyrosulfit, ist ein Konservierungsmittel, das häufig bei der Weinherstellung und Lebensmittelverarbeitung verwendet wird. Es setzt Schwefeldioxid frei, das das Wachstum von Bakterien und Hefen hemmt und so die Haltbarkeit von Produkten verlängert.
| Name der IUPAC | Kaliumpyrosulfit |
| Molekularformel | K2S2O5 |
| CAS-Nummer | 16731-55-8 |
| Synonyme | Kaliumdisulfit, pyroschwefelige Säure, Dikaliumsalz, Kaliummetabisulfit |
| InChI | InChI=1S/2K.H2O5S2/c;;1-6(2)7(3,4)5/h;;(H,1,2)(H,3,4,5)/q2*+1; /p-2 |
Eigenschaften von Kaliummetabisulfit
Kaliummetabisulfit-Formel
Die chemische Formel für Kaliummetabisulfit lautet K2S2O5. Das bedeutet, dass jedes Kaliummetabisulfit-Molekül zwei Kaliumionen, zwei Schwefelatome und fünf Sauerstoffatome enthält. Die Formel ist wichtig für die Bestimmung der chemischen Eigenschaften und des Verhaltens von K2S2O5 in verschiedenen Reaktionen und Prozessen.
Molmasse von Kaliummetabisulfit
K2S2O5 hat eine Molmasse von 222,31 g/mol. Dies wird durch Addition der Atommassen seiner Bestandteile berechnet: zwei Kaliumatome (jeweils 39,10 g/mol), zwei Schwefelatome (jeweils 32,06 g/mol) und fünf Sauerstoffatome (jeweils 16,00 g/mol). . Die Molmasse ist wichtig, um die Menge an K2S2O5 zu bestimmen, die in einer bestimmten Reaktion oder einem bestimmten Prozess benötigt wird.
Siedepunkt von Kaliummetabisulfit
K2S2O5 hat keinen definierten Siedepunkt, da es sich vor Erreichen des Siedepunkts zersetzt. Bei hohen Temperaturen zerfällt K2S2O5 unter Freisetzung von Schwefeldioxid, dem Wirkstoff, der als Konservierungsmittel wirkt.
Kaliummetabisulfit Schmelzpunkt
K2S2O5 hat einen Schmelzpunkt von etwa 190 °C (374 °F). Bei dieser Temperatur schmilzt die feste Verbindung und wird zu einer klaren Flüssigkeit. Der Schmelzpunkt ist wichtig für die Bestimmung der geeigneten Handhabungs- und Lagerbedingungen für K2S2O5.
Dichte von Kaliummetabisulfit g/ml
Die Dichte von K2S2O5 beträgt etwa 2,34 g/ml. Das bedeutet, dass ein gegebenes Volumen K2S2O5 2,34-mal mehr wiegt als das gleiche Volumen Wasser. Die Dichte ist wichtig, um die geeignete Menge an K2S2O5 zu bestimmen, die in einem bestimmten Prozess verwendet werden soll.
Molekulargewicht von Kaliummetabisulfit
Das Molekulargewicht von K2S2O5 beträgt 222,31 g/mol. Dies wird durch Addition der Atommassen seiner Bestandteile berechnet: zwei Kaliumatome, zwei Schwefelatome und fünf Sauerstoffatome. Das Molekulargewicht ist wichtig für die Bestimmung der Menge an K2S2O5, die in einer bestimmten Reaktion oder einem bestimmten Prozess benötigt wird.
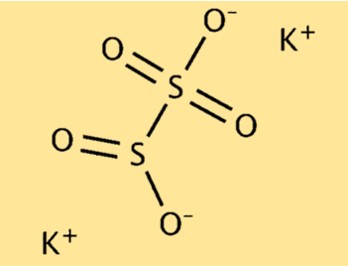
Struktur von Kaliummetabisulfit
K2S2O5 hat eine Molekülstruktur, die aus zwei Kaliumionen (K+) und einem Pyrosulfit-Ion (S2O5^2-) besteht. Das Pyrosulfit-Ion besteht aus zwei Schwefelatomen und fünf Sauerstoffatomen. Die beiden Kaliumionen werden vom negativ geladenen Pyrosulfit-Ion angezogen und bilden eine stabile ionische Verbindung.
Löslichkeit von Kaliummetabisulfit
K2S2O5 ist in Wasser, Alkohol und Glycerin löslich. Seine Löslichkeit in Wasser variiert je nach Temperatur und Konzentration. Bei Raumtemperatur ist es mit einer Löslichkeit von etwa 70 g/100 ml sehr gut wasserlöslich. Bei höheren Konzentrationen kann es jedoch zu einer schlechteren Löslichkeit und zur Bildung von Niederschlägen kommen.
| Aussehen | Weißes oder hellgelbes kristallines Pulver |
| Spezifisches Gewicht | 2,34 bei 20°C |
| Farbe | Weiß bis leicht gelb |
| Geruch | Schwefelhaltig, würzig |
| Molmasse | 222,31 g/Mol |
| Dichte | 2,34 g/ml bei 25 °C |
| Fusionspunkt | 190–240 °C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Nicht anwendbar (fest) |
| Löslichkeit in Wasser | In Wasser löslich |
| Löslichkeit | Löslich in Ethanol und Glycerin, schwer löslich in Ether |
| Dampfdruck | Bei Raumtemperatur vernachlässigbar |
| Wasserdampfdichte | Nicht anwendbar (fest) |
| pKa | 4.34 |
| pH-Wert | 4,5–5,5 in 10 %iger Lösung |
Sicherheit und Gefahren von Kaliummetabisulfit
K2S2O5 kann bei unsachgemäßer Handhabung ein Sicherheitsrisiko darstellen. Beim Einatmen kann es zu Hautreizungen, Augenreizungen und Atemproblemen kommen. Direkter Kontakt mit der Substanz kann zu Rötungen, Juckreiz und Brennen führen. Bei Verschlucken kann es auch zu Verdauungsproblemen kommen. Der Stoff kann beim Erhitzen giftiges Schwefeldioxidgas freisetzen. Während der Handhabung und Lagerung ist daher eine ausreichende Belüftung erforderlich. Beim Umgang mit K2S2O5 ist es wichtig, geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen. Auch die richtige Lagerung ist entscheidend, da es mit Säuren, Metallen und anderen Chemikalien reagieren kann.
| Gefahrensymbole | Xi (irritierend) |
| Sicherheitsbeschreibung | Behälter dicht verschlossen und trocken halten; Nicht einnehmen; Tragen Sie geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz; Bei Augenkontakt sofort mit reichlich Wasser spülen und einen Arzt konsultieren; Bei Verschlucken sofort ärztlichen Rat einholen und Verpackung oder Etikett vorzeigen. |
| UN-Identifikationsnummern | UN 2676 |
| HS-Code | 2832.10.00 |
| Gefahrenklasse | 8 – Ätzende Stoffe |
| Verpackungsgruppe | III |
| Toxizität | LD50 (Ratte, oral) – 2.000 mg/kg; LC50 (Ratte, Inhalation) – 17 ppm/4h |
Methoden zur Synthese von Kaliummetabisulfit
Verschiedene Methoden können K2S2O5 synthetisieren.
Eine übliche Methode beinhaltet die Reaktion zwischen Kaliumhydroxid und Schwefeldioxid. Das Reaktionsgefäß vereint die beiden Chemikalien und erhitzt sie. Das entstehende Gas strömt durch das Wasser und erzeugt dabei Kaliumsulfit . Wasserstoffperoxid oxidiert Kaliumsulfit und bildet Kaliumsulfat. Schwefeldioxid reagiert mit Kaliumsulfat zu K2S2O5.
Eine andere Methode beinhaltet die Reaktion von Kaliumcarbonat und Schwefeldioxid. Das Reaktionsgefäß vermischt die beiden Chemikalien und erhitzt sie. Die Mischung erzeugt ein Gas, das durch eine Kaliumsulfitlösung strömt und dabei Kaliumbisulfit erzeugt. Wasserstoffperoxid oxidiert Kaliumbisulfit und bildet Kaliumsulfat. Schwefeldioxid reagiert mit Kaliumsulfat unter Bildung von K2S2O5.
Verwendung von Kaliummetabisulfit
K2S2O5 hat ein breites Anwendungsspektrum in verschiedenen Branchen. Einige häufige Verwendungszwecke sind:
- Lebensmittelkonservierung: Wird als Lebensmittelkonservierungsmittel verwendet, um den Verderb zu verhindern und die Haltbarkeit zu verlängern. Wird häufig bei der Herstellung von Wein, Bier und Fruchtsäften verwendet.
- Fotografie: Wird in der Fotografie als Entwickler und Fixierer für Filme und Drucke verwendet.
- Textilindustrie: Wird in der Textilindustrie verwendet, um überschüssiges Färben und Bleichen aus Stoffen zu entfernen.
- Wasseraufbereitung: Wird als Wasseraufbereitungschemikalie zur Entfernung von Chlor und anderen Verunreinigungen verwendet.
- Pharmazeutische Industrie: Wird in der pharmazeutischen Industrie als Antioxidans verwendet, um den Abbau von Arzneimitteln zu verhindern.
- Goldabbau: Wird beim Goldabbau verwendet, um Gold von anderen Metallen und Verunreinigungen zu trennen.
- Chemische Herstellung: Wird bei der Herstellung verschiedener Chemikalien wie Farbstoffe, Harze und Kunststoffe verwendet.
- Zellstoff- und Papierindustrie: Wird in der Zellstoff- und Papierindustrie zum Weißen von Papierprodukten verwendet.
Fragen:
F: Wie viel Kaliummetabisulfit pro Gallone?
A: Die pro Gallone benötigte Menge an K2S2O5 variiert je nach Verwendungszweck. Für die Weinherstellung beträgt die empfohlene Menge 1/16 bis 1/4 Teelöffel pro Gallone. Für die Herstellung von Apfelwein beträgt die empfohlene Menge 1/4 Teelöffel pro Gallone. Es ist wichtig, die empfohlene Dosierung genau einzuhalten, um die gewünschte Wirkung zu gewährleisten und einen übermäßigen Konsum zu vermeiden, der schädlich sein kann.
F: Wann sollte ich Kaliumsorbat oder Kaliummetabisulfit verwenden?
A: Kaliumsorbat und K2S2O5 werden beide als Konservierungsmittel in der Lebensmittel- und Getränkeindustrie verwendet. Kaliumsorbat wird verwendet, um das Wachstum von Hefen und Schimmel zu verhindern, während K2S2O5 verwendet wird, um das Wachstum und die Oxidation von Bakterien zu hemmen. Kaliumsorbat wird typischerweise in säurefreien Produkten wie Sirupen und Marmeladen verwendet, während K2S2O5 in säurehaltigen Produkten wie Wein und Apfelwein verwendet wird. Die Wahl zwischen den beiden Kondomen hängt vom jeweiligen Produkt und seinen Anforderungen ab.
F: Wo kann man Kaliummetabisulfit kaufen?
A: K2S2O5 kann in Chemiegeschäften, Online-Händlern und Heimbrauereien gekauft werden. Es ist wichtig sicherzustellen, dass das Produkt von hoher Qualität ist und für den vorgesehenen Verwendungszweck bestimmt ist.
F: Wie viel Kaliummetabisulfit pro Gallone Apfelwein?
A: Die empfohlene Menge an K2S2O5 für die Herstellung von Apfelwein beträgt 1/4 Teelöffel pro Gallone. Diese Menge wird nach der Gärung hinzugefügt, um Oxidation und Bakterienwachstum zu verhindern und den Geschmack und die Qualität des Apfelweins zu bewahren.
F: Was ist der Unterschied zwischen K2S2O5 und K2S2O8?
A: K2S2O5 und K2S2O8 sind beide Kaliumsalze, haben jedoch unterschiedliche Strukturen und chemische Eigenschaften. K2S2O5 ist ein weißes kristallines Pulver, das als Konservierungsmittel und Antioxidans verwendet wird, während K2S2O8 ein starkes Oxidationsmittel ist, das bei chemischen Reaktionen wie der organischen Synthese und der Abwasserbehandlung verwendet wird. Der Hauptunterschied zwischen den beiden besteht in ihren chemischen Eigenschaften und ihrem Verwendungszweck.
