Kaliumhypochlorit (KClO) ist eine chemische Verbindung, die häufig als Desinfektionsmittel und Bleichmittel verwendet wird. Es hat einen starken Geruch und kann bei unsachgemäßer Handhabung gefährlich sein.
| IUPAC-Name | Kaliumhypochlorit |
| Molekularformel | KClO |
| CAS-Nummer | 7778-66-7 |
| Synonyme | Hypochlorige Säure, Kaliumsalz; Kaliumoxychlorid; Kaliumchlorat(I) |
| InChI | InChI=1S/ClO.K/h1H;/q;+1/p-1 |
Eigenschaften von Kaliumhypochlorit
Kaliumhypochlorit-Formel
Die chemische Formel für Kaliumhypochlorit lautet KClO. Es besteht aus einem Kaliumion, einem Chloratom und einem Sauerstoffatom. Kaliumhypochlorit ist bei Raumtemperatur ein weißer Feststoff und hat einen starken Chlorgeruch. Es wird häufig als Desinfektions- und Bleichmittel in verschiedenen Branchen eingesetzt.
Molmasse von Kaliumhypochlorit
Die Molmasse von KClO beträgt 90,55 g/mol. Sie ist die Summe der Atommassen der Grundelemente Kalium, Chlor und Sauerstoff. Die Molmasse ist ein wichtiger Parameter für die Stöchiometrie und andere chemische Berechnungen.
Siedepunkt von Kaliumhypochlorit
KClO zersetzt sich, bevor es seinen Siedepunkt erreicht. Sein Siedepunkt ist daher nicht genau definiert. Beim Erhitzen zerfällt es in Kaliumchlorid und Sauerstoffgas. Die Zersetzung von KClO ist eine exotherme Reaktion und kann bei unsachgemäßer Handhabung gefährlich sein.
Kaliumhypochlorit Schmelzpunkt
Der Schmelzpunkt von KClO liegt bei 100 bis 102 °C. Bei Raumtemperatur ist es ein weißer Feststoff und schmilzt beim Erhitzen. Der Schmelzpunkt ist eine wichtige physikalische Eigenschaft eines Stoffes und dient der Identifizierung und Charakterisierung des Stoffes.
Dichte von Kaliumhypochlorit g/ml
Die Dichte von KClO beträgt 2,35 g/ml. Das bedeutet, dass ein Milliliter KClO 2,35 Gramm wiegt. Die Dichte ist ein Maß für die Masse pro Volumeneinheit eines Stoffes und ein wichtiger Parameter in chemischen Berechnungen.
Molekulargewicht von Kaliumhypochlorit
Das Molekulargewicht von KClO beträgt 90,55 g/mol. Es ist die Summe der Atomgewichte der Bestandteile eines KClO-Moleküls. Das Molekulargewicht wird in chemischen Berechnungen wie der Bestimmung der Molmasse und der Stöchiometrie verwendet.
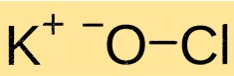
Struktur von Kaliumhypochlorit
KClO hat eine Kristallstruktur. Es besteht aus K+-Kationen und ClO–Anionen, die durch ionische Bindungen zusammengehalten werden. Die Struktur von KClO ähnelt der anderer ionischer Verbindungen und wird durch die Ladung und Größe der konstituierenden Ionen bestimmt.
Löslichkeit von Kaliumhypochlorit
KClO ist in Wasser sehr gut löslich. Beim Auflösen in Wasser bildet es eine Lösung aus K+-Kationen und ClO–Anionen. Die Löslichkeit von KClO in Wasser wird durch Temperatur und pH-Wert beeinflusst. Höhere Temperaturen und niedrigere pH-Werte erhöhen die Löslichkeit von KClO in Wasser.
| Aussehen | Weißer Feststoff |
| Spezifisches Gewicht | 2,35 |
| Farbe | Weiß |
| Geruch | Starker Chlorgeruch |
| Molmasse | 90,55 g/Mol |
| Dichte | 2,35 g/ml |
| Fusionspunkt | 100–102 °C |
| Siedepunkt | Zersetzt sich vor dem Siedepunkt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | In Wasser löslich |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Alkalisch (pH 11-13) |
Sicherheit und Gefahren von Kaliumhypochlorit
KClO kann bei unsachgemäßer Handhabung gefährlich sein. Es ist ein starkes Oxidationsmittel, das mit organischen Materialien unter Bildung gefährlicher Verbindungen reagieren kann. KClO ist außerdem ein starker Reizstoff für Haut, Augen und Atemwege. Direkter Hautkontakt kann zu Verbrennungen und Reizungen führen. Das Einatmen von KClO-Dämpfen kann zu Husten, pfeifenden Atemgeräuschen und Kurzatmigkeit führen. Die Verbindung sollte in einem gut belüfteten Bereich mit geeigneter persönlicher Schutzausrüstung wie Handschuhen, Schutzbrille und Atemschutzgerät gehandhabt werden. Im Falle einer versehentlichen Exposition sollte sofort ein Arzt aufgesucht werden.
| Gefahrensymbole | Oxidationsmittel |
| Sicherheitsbeschreibung | Tragen Sie Handschuhe und Augen-/Gesichtsschutz. Von brennbaren Materialien fernhalten. Kontakt mit Haut und Augen vermeiden. |
| UN-Identifikationsnummern | UN1748 |
| HS-Code | 2828.90.10 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Kann beim Verschlucken gesundheitsschädlich sein. Verursacht schwere Hautverbrennungen und Augenschäden. Kann Reizungen der Atemwege verursachen. |
Methoden zur Synthese von Kaliumhypochlorit
Es gibt verschiedene Methoden zur Synthese von Kaliumhypochlorit.
Eine übliche Methode ist die Reaktion von Chlorgas mit einer Kaliumhydroxidlösung . Bei der Reaktion entstehen KClO und Kaliumchlorid als Nebenprodukte:
Cl2 + 2KOH → KCl + KClO + H2O
Eine andere Methode beinhaltet die Reaktion von Calciumhypochlorit mit Kaliumchlorid . Bei dieser Reaktion entstehen KClO und Calciumchlorid als Nebenprodukte:
Ca(ClO)2 + 2 KCl → 2 KClO + CaCl2
Zur Synthese von KClO kann hypochlorige Säure mit Kaliumhydroxid umgesetzt werden.
2 KOH + HOCl → KClO + KCl + H2O
Zur Herstellung von KClO kann Elektrolyse eingesetzt werden, bei der ein elektrischer Strom durch eine Lösung aus Wasser und Kaliumchlorid geleitet wird. Bei der Reaktion entstehen KClO, Wasserstoffgas und Kaliumhydroxid als Nebenprodukte:
2 KCl + 2 H2O → 2 KOH + Cl2 + H2
Das synthetisierte KClO sollte an einem kühlen, trockenen Ort ohne direkte Sonneneinstrahlung und Hitze gelagert werden.
Verwendung von Kaliumhypochlorit
KClO hat vielfältige Einsatzmöglichkeiten in verschiedenen Branchen und Anwendungen. Hier sind einige seiner häufigsten Verwendungszwecke:
- Wasseraufbereitung: Wird als Desinfektionsmittel in Wasseraufbereitungsanlagen verwendet, um Bakterien und andere Schadorganismen abzutöten.
- Bleichmittel: Wird in der Textilindustrie als Bleichmittel zum Aufhellen von Stoffen verwendet.
- Desinfektionsmittel: Wird in der Lebensmittelindustrie als Desinfektionsmittel zur Desinfektion von Oberflächen und Geräten verwendet, die mit Lebensmitteln in Berührung kommen.
- Poolpflege: Wird als Desinfektionsmittel und Algizid in Schwimmbädern verwendet, um das Wasser sauber und klar zu halten.
- Sterilisation: Wird zur Sterilisation in medizinischen Einrichtungen und Labors zur Desinfektion von Geräten und Oberflächen verwendet.
- Desodorierungsmittel: Wird als Desodorierungsmittel in Kläranlagen verwendet, um unangenehme Gerüche zu neutralisieren.
- Zellstoff- und Papierindustrie: Wird in der Zellstoff- und Papierindustrie als Bleichmittel für Papierprodukte verwendet.
- Landwirtschaft: Wird in der Landwirtschaft als Pestizid und Fungizid zum Schutz von Nutzpflanzen vor Schädlingen und Krankheiten eingesetzt.
- Desinfektionsmittel: Wird als Desinfektionsmittel in Haushaltsreinigern verwendet, um Keime und Bakterien abzutöten.
- Öl- und Gasindustrie: Wird in der Öl- und Gasindustrie zur Behandlung von Ölquellen und Pipelines verwendet, um Bakterien zu bekämpfen und Korrosion zu verhindern.
Fragen:
F: Was ist Kaliumhypochlorit?
A: Kaliumhypochlorit ist eine chemische Verbindung mit der Formel KClO, die üblicherweise als Desinfektionsmittel, Bleichmittel und Wasseraufbereitungschemikalie verwendet wird.
F: Wie hoch ist der pH-Wert einer 0,42 M KClO-Lösung? [Ka(HClO) = 4,0 × 10–8]
A: Der pH-Wert einer 0,42 M KClO-Lösung kann anhand des Ka-Werts der zugehörigen Säure HClO berechnet werden. Der pH-Wert liegt bei etwa 12,69.
F: Was ist Natriumhypochlorit und Kaliumhydroxid?
A: Natriumhypochlorit ist eine chemische Verbindung mit der Formel NaClO, die üblicherweise als Bleich- und Desinfektionsmittel verwendet wird. Kaliumhydroxid ist eine chemische Verbindung mit der Formel KOH, die häufig bei der Seifenherstellung und als Laborreagenz verwendet wird.
F: Wie hoch ist der pH-Wert einer 0,116 M wässrigen Lösung von KClO?
A: Der pH-Wert einer 0,116 M wässrigen Lösung von KClO kann anhand des Kb-Werts seiner konjugierten Base ClO- berechnet werden. Der pH-Wert liegt bei etwa 11,31.
F: Wie hoch ist der pH-Wert einer 0,191 M wässrigen Lösung von KClO?
A: Der pH-Wert einer 0,191 M wässrigen Lösung von KClO kann anhand des Kb-Werts seiner konjugierten Base ClO- berechnet werden. Der pH-Wert liegt bei etwa 11,92.
F: Ist KClO löslich?
A: Ja, KClO ist wasserlöslich und bildet eine alkalische Lösung.
F: Kann ich Natriumhypochlorit und Kaliumhypochlorit mischen?
A: Das Mischen von Natriumhypochlorit und KClO wird nicht empfohlen, da es zu einer chemischen Reaktion führen kann, bei der Hitze, Gase und möglicherweise schädliche Nebenprodukte entstehen.
