Kaliumfluorid (KF) ist eine chemische Verbindung bestehend aus K+- und F–Ionen. Es wird in verschiedenen industriellen Anwendungen wie der Aluminiumproduktion und Dentalprodukten eingesetzt.
| IUPAC-Name | Kaliumfluorid |
| Molekularformel | K.F. |
| CAS-Nummer | 7789-23-3 |
| Synonyme | Kaliummonofluorid, Kaliumfluorid, Kaliumfluorid, UN 1812, EINECS 232-151-5 |
| InChI | InChI=1S/FH.K/h1H;/q;+1/p-1 |
Eigenschaften von Kaliumfluorid
Kaliumfluorid-Formel
Die chemische Formel für Kaliumfluorid ist KF, was bedeutet, dass sich ein Kaliumion und ein Fluoridion zu einer einzigen Formeleinheit der Verbindung verbinden. Die Formel für Kaliumfluorid eignet sich zur Bestimmung der Stöchiometrie chemischer Reaktionen, an denen die Verbindung beteiligt ist, sowie zur Identifizierung der in einer bestimmten Probe vorhandenen Elemente.
Molmasse von Kaliumfluorid
KF hat eine Molmasse von 58,10 g/mol. Es handelt sich um eine Verbindung aus K+- und F–Ionen mit einem Kaliumion und einem Fluoridion pro Formeleinheit. Die Molmasse ist die Summe der Atommassen der Elemente einer Verbindung, die in diesem Fall 39,10 g/mol für Kalium und 19,00 g/mol für Fluor betragen. Die Kenntnis der Molmasse von KF ist nützlich, um die Menge der in einer bestimmten Probe vorhandenen Verbindung zu bestimmen und stöchiometrische Verhältnisse bei chemischen Reaktionen zu berechnen.
Siedepunkt von Kaliumfluorid
KF hat einen hohen Siedepunkt von 1.503 °C (2.737 °F). Dies ist auf die starke Ionenbindung zwischen den K+- und F–Ionen zurückzuführen, die eine große Energiemenge erfordert, um aufzubrechen und der Verbindung den Eintritt in die Gasphase zu ermöglichen. Der Siedepunkt von KF macht es nützlich für Hochtemperaturanwendungen, beispielsweise in der Aluminiumproduktion, wo es als Flussmittel zur Entfernung von Verunreinigungen aus dem Metall verwendet wird.
Kaliumfluorid Schmelzpunkt
KF hat einen relativ niedrigen Schmelzpunkt von 858 °C (1.576 °F). Dies ist auch auf die ionische Natur der Verbindung zurückzuführen, da die starke Anziehungskraft zwischen positiven und negativen Ionen mit zunehmender Temperatur geschwächt wird und die Verbindung in die flüssige Phase gelangen kann. Der niedrige Schmelzpunkt von KF macht es für verschiedene Anwendungen nützlich, beispielsweise für die Glas- und Keramikherstellung.
Dichte von Kaliumfluorid g/ml
Die Dichte von KF beträgt 2,48 g/ml bei Raumtemperatur. Dieser Wert wird durch die kompakte Kristallstruktur der Verbindung sowie die relativ hohe Masse der K+- und F–Ionen beeinflusst. Die Dichte von KF ist nützlich, um das von einer bestimmten Masse der Verbindung eingenommene Volumen zu bestimmen und ihr Verhalten in verschiedenen Umgebungen vorherzusagen.
Molekulargewicht von Kaliumfluorid
Das Molekulargewicht von KF beträgt 58,10 g/mol. Dieser Wert wird durch Addition der Atomgewichte der K+- und F–Ionen in einer Formeleinheit der Verbindung ermittelt. Das Molekulargewicht von KF ist wichtig für die Bestimmung seiner physikalischen und chemischen Eigenschaften sowie für die Berechnung stöchiometrischer Verhältnisse bei chemischen Reaktionen.
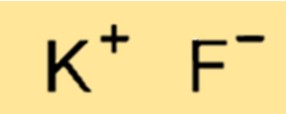
Struktur von Kaliumfluorid
KF hat eine Kristallstruktur, die aus abwechselnden K+- und F–Ionen besteht. Die Ionen werden durch starke Ionenbindungen zusammengehalten, was zu einer sehr stabilen und starren Struktur führt. Die Struktur von KF ist wichtig für die Bestimmung seiner physikalischen und chemischen Eigenschaften sowie für die Vorhersage seines Verhaltens in verschiedenen Anwendungen.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2,48 bei 20°C |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 58,10 g/Mol |
| Dichte | 2,48 g/ml bei 20 °C |
| Fusionspunkt | 858°C |
| Siedepunkt | 1503°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 92,5 g/100 ml bei 25 °C |
| Löslichkeit | Löslich in Alkohol, unlöslich in Ether |
| Dampfdruck | 1 mmHg bei 737 °C |
| Wasserdampfdichte | Unzutreffend |
| pKa | 7.3 |
| pH-Wert | 7 (neutral) |
Sicherheit und Gefahren von Kaliumfluorid
KF kann gefährlich sein, wenn es nicht richtig gehandhabt wird. Es ist sehr ätzend und kann bei Kontakt schwere Verätzungen der Haut, Augen und Atemwege verursachen. Das Einatmen von KF-Staub oder -Dampf kann die Atemwege reizen und Husten und Kurzatmigkeit verursachen. Eine langfristige Exposition gegenüber KF kann zu chronischen Lungenschäden und Skelettfluorose führen. Beim Umgang mit KF ist es wichtig, Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen und das Einatmen von Staub oder Dämpfen zu vermeiden. Bei Exposition sollte sofort ein Arzt aufgesucht werden.
| Gefahrensymbole | Totenkopf, ätzend |
| Sicherheitsbeschreibung | Unter Verschluss und außerhalb der Reichweite von Kindern aufbewahren. Staub nicht einatmen. Tragen Sie geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz. Bei Augenkontakt sofort mit reichlich Wasser spülen und einen Arzt aufsuchen. Bei Unfall oder Unwohlsein sofort einen Arzt aufsuchen (wenn möglich dieses Etikett vorzeigen). |
| UN-Identifikationsnummern | UN1812 |
| HS-Code | 2826.12.00 |
| Gefahrenklasse | 6.1 |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig; Oraler LD50 (Ratte) 52 mg/kg |
Methoden zur Kaliumfluorid-Synthese
Mehrere Methoden können KF synthetisieren. Eine übliche Methode ist die Reaktion von Flusssäure (HF) mit Kaliumhydroxid (KOH) . Bei der Reaktion entstehen KF und Wasser wie folgt:
HF + KOH → KF + H2O
Eine weitere Methode ist die Reaktion zwischen Kaliumcarbonat (K2CO3) und Flusssäure . Bei der Reaktion entstehen KF, Wasser und Kohlendioxid wie folgt:
2HF + K2CO3 → 2KF + CO2 + H2O
Bei hohen Temperaturen entstehen durch die Reaktion zwischen Fluorwasserstoffgas (HF) und Kaliumchlorid (KCl) KF und Chlorwasserstoffgas (HCl).
KCl + HF → KF + HCl
Die oben genannten Methoden erfordern Vorsicht, da Flusssäure oder Fluorwasserstoff stark ätzend und giftig sind.
Verwendung von Kaliumfluorid
Kaliumfluorid wird in verschiedenen Industriezweigen vielfältig eingesetzt. Hier sind einige seiner Verwendungsmöglichkeiten:
- Als Flussmittel in der Metallurgie: Wird als Flussmittel bei der Herstellung von Aluminium und anderen Metallen verwendet. Es hilft, Verunreinigungen aus dem Metall zu entfernen und seine Qualität zu verbessern.
- Bei der Herstellung anderer Chemikalien: Wird bei der Herstellung mehrerer anderer Chemikalien wie Kryolith und Aluminiumfluorid verwendet.
- Bei der Glasherstellung: Wird dem Glas zugesetzt, um seinen Schmelzpunkt zu senken und seine Haltbarkeit und optischen Eigenschaften zu verbessern.
- Bei der Herstellung von Pestiziden: Wird bei der Herstellung bestimmter Pestizide als Stabilisator und Katalysator verwendet.
- Bei der Zahnpasta-Herstellung: Wird der Zahnpasta als Fluoridzusatz zugesetzt, um Karies vorzubeugen.
- In Kernreaktoren: Wird in Kernreaktoren als Kühlmittel und zur Verhinderung der Korrosion von Reaktorkomponenten verwendet.
- In der analytischen Chemie: Wird in der analytischen Chemie verwendet, um die Konzentration bestimmter Elemente in einer Probe zu bestimmen.
Fragen:
F: Was ist KF in der Chemie?
A: KF ist die chemische Formel für Kaliumfluorid. Es ist eine anorganische Verbindung, die aus einem Kaliumion und einem Fluoridion besteht.
F: Ist KF eine Säure oder eine Base?
A: KF ist ein Salz, das weder eine Säure noch eine Base ist. Es kann jedoch in Wasser hydrolysiert werden, um eine basische Lösung zu bilden.
F: Leitet Kaliumfluorid Strom?
A: KF ist eine ionische Verbindung, die Elektrizität leiten kann, wenn sie in Wasser gelöst oder geschmolzen wird. Tatsächlich können sich Ionen frei bewegen und eine elektrische Ladung tragen.
F: Wie lautet die Formel für Kaliumfluorid?
A: Die Formel für Kaliumfluorid lautet KF. Die Verbindung besteht aus einem K+-Ion und einem F–Ion.
