Kaliumcyanid ist eine hochgiftige Verbindung. Es wird in industriellen Anwendungen eingesetzt und kann bei Verschlucken schwere Schäden verursachen. Bei der Handhabung ist äußerste Vorsicht geboten.
| IUPAC-Name | Kaliumcyanid |
| Molekularformel | KCN |
| CAS-Nummer | 151-50-8 |
| Synonyme | Kaliumcyanid, Kaliumsalz der Blausäure |
| InChI | InChI=1S/CN.K/c1-2;/q-1;+1 |
Eigenschaften von Kaliumcyanid
Kaliumcyanid-Formel
Die chemische Formel für Kaliumcyanid lautet KCN. Es besteht aus einem K-Atom, das an ein CN-Ion gebunden ist. Die Formel stellt das Verhältnis der Atome in einem KCN-Molekül dar.
Molmasse von Kaliumcyanid
Die Molmasse von KCN wird durch Addition der Atommassen seiner Bestandteile berechnet. K hat eine Atommasse von 39,10 g/mol, während CN eine kombinierte Atommasse von 26,01 g/mol hat. Die Molmasse von KCN beträgt somit 65,11 g/mol.
Siedepunkt von Kaliumcyanid
KCN hat einen hohen Siedepunkt von etwa 1.634 Grad Celsius (2.963 Grad Fahrenheit). Diese Temperatur gibt den Punkt an, an dem die flüssige Form von KCN in ein Gas übergeht.
Schmelzpunkt von Kaliumcyanid
Der Schmelzpunkt von KCN liegt bei etwa 634 Grad Celsius (1.173 Grad Fahrenheit). Diese Temperatur stellt den Übergang vom festen Zustand in den flüssigen Zustand dar.
Dichte von Kaliumcyanid g/ml
Die Dichte von KCN beträgt etwa 1,52 g/ml. Diese Messung gibt die Masse der Substanz pro Volumeneinheit an, wobei eine höhere Dichte auf eine größere Masse in einem bestimmten Volumen hinweist.
Molekulargewicht von Kaliumcyanid
Das Molekulargewicht von KCN, auch Molmasse genannt, beträgt 65,11 g/mol. Dieser Wert stellt die Summe der Atommassen aller Atome in einem KCN-Molekül dar.
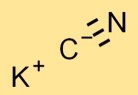
Struktur von Kaliumcyanid
Die Struktur von KCN besteht aus einem K+-Kation und einem CN–Anion. Das K+-Ion ist positiv geladen, während das CN–Ion eine negative Ladung trägt. Sie werden durch Ionenbindungen zusammengehalten.
Löslichkeit von Kaliumcyanid
KCN ist in Wasser gut löslich. Es löst sich leicht in Wasser und bildet eine farblose Lösung. Diese Eigenschaft erleichtert die Handhabung und den Einsatz in verschiedenen industriellen Anwendungen. Aufgrund seiner Löslichkeit ist jedoch auch Vorsicht beim Umgang geboten.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 1,52 g/ml |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 65,11 g/Mol |
| Dichte | 1,52 g/ml |
| Fusionspunkt | 634 Grad Celsius (1.173 Grad Fahrenheit) |
| Siedepunkt | 1.634 Grad Celsius (2.963 Grad Fahrenheit) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | In Wasser löslich |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Basisch (alkalisch) |
Sicherheit und Gefahren von Kaliumcyanid
KCN birgt erhebliche Sicherheitsrisiken und sollte mit äußerster Vorsicht gehandhabt werden. Es ist hochgiftig, wenn es verschluckt, eingeatmet oder über die Haut aufgenommen wird. Direkter Kontakt mit KCN kann zu schweren Verbrennungen und Reizungen führen. Es setzt giftiges HCN-Gas frei, wenn es Säuren ausgesetzt oder erhitzt wird. Bei der Arbeit mit dieser Verbindung sind eine ausreichende Belüftung und persönliche Schutzausrüstung wie Handschuhe und Schutzbrillen unerlässlich. Die Lagerung sollte an einem sicheren, gut belüfteten Ort und fern von unverträglichen Substanzen erfolgen. Bei Exposition oder Verschlucken ist sofortige ärztliche Hilfe erforderlich. KCN-Gefahren erfordern die strikte Einhaltung von Sicherheitsprotokollen, um Risiken für die menschliche Gesundheit und die Umwelt zu minimieren.
| Gefahrensymbole | Totenkopf, ätzend |
| Sicherheitsbeschreibung | Sehr giftig, ätzend, gefährlich für die Umwelt |
| UN-Identifikationsnummern | UN1680, UN1585 |
| HS-Code | 2837.11.00 |
| Gefahrenklasse | 6.1 (Giftige Stoffe), 8 (Ätzende Stoffe) |
| Verpackungsgruppe | GE II |
| Toxizität | Extrem giftig |
Methoden zur Kaliumcyanid-Synthese
Verschiedene Methoden ermöglichen die Synthese von KCN.
Bei der Synthese von KCN wird bei einer gängigen Methode eine Lösung von HCN-Gas durch eine Lösung von Kaliumhydroxid (KOH) geleitet. Bei der Reaktion zwischen den beiden Verbindungen entstehen KCN und Wasser als Nebenprodukt.
Bei dieser Methode reagiert Kaliumcarbonat (K2CO3) mit NH4CN, wenn diese gemischt und erhitzt werden. Als Ergebnis entstehen bei der Reaktion KCN, Ammoniak und Kohlendioxid.
Um KCN zu erhalten, kann Kaliumchlorid (KCl) mit NaCN umgesetzt werden, wodurch es zu einem Ionenaustausch zwischen den Verbindungen kommt. Dieser Prozess führt zur Bildung von KCN und Natriumchlorid (NaCl) .
Die KCN-Synthese sollte ausschließlich von Fachkräften durchgeführt werden, die über Kenntnisse im Umgang mit Gefahrstoffen verfügen und die erforderlichen Sicherheitsvorkehrungen getroffen haben. Aufgrund der extremen Toxizität von KCN ist die strikte Einhaltung geeigneter Laborpraktiken und -protokolle von entscheidender Bedeutung, um die Sicherheit der Beteiligten zu gewährleisten und potenzielle Umweltgefahren zu verhindern.
Verwendung von Kaliumcyanid
KCN wird in unterschiedlichen Branchen vielfältig eingesetzt. Hier sind einige seiner Anwendungen:
- Goldbergbau: Goldbergbauunternehmen nutzen üblicherweise KCN, um Gold aus Erzen zu gewinnen. Sie vermischen es mit dem Erz, um einen löslichen Komplex zu bilden, der das Gold von anderen Mineralien trennt.
- Chemische Industrie: Die chemische Industrie verwendet KCN als Vorläufer zur Herstellung verschiedener Chemikalien, darunter organische Cyanide, Adiponitril und Kaliumferrocyanid. Hersteller verwenden diese Verbindungen bei der Herstellung von Arzneimitteln, Farbstoffen und Pigmenten.
- Metallbeschichtung: KCN spielt eine entscheidende Rolle bei Galvanisierungsprozessen und sorgt für eine glatte, haftende Metallbeschichtung auf Oberflächen. Besonders wirksam ist es bei der Versilberung und Verzinkung.
- Analytische Chemie: Analytische Labore verwenden KCN als Reagenz für verschiedene Analysetechniken. Es findet Anwendung in Titrationsreaktionen und dient als Quelle für Cyanidionen in komplexometrischen Titrationen.
- Schädlingsbekämpfung: In einigen Fällen wirkt KCN als Rodentizid zur Bekämpfung von Nagetierpopulationen. Aufgrund seiner extrem giftigen Natur unterliegen seine Verwendung jedoch strengen Vorschriften.
- Begasung: KCN dient aufgrund seiner hohen Toxizität als wirksames Begasungsmittel zur Beseitigung von Schädlingen in gelagertem Getreide, Schiffsladungen und Strukturen und gewährleistet so eine wirksame Schädlingsbekämpfung.
- Fotografie: In der Vergangenheit beauftragte die Fotoindustrie KCN mit der Entwicklung und Fixierung von Schwarzweißfilmen. Aus Sicherheitsgründen werden in der Industrie jedoch zunehmend alternative Chemikalien eingesetzt.
Es ist unbedingt zu beachten, dass die Verwendung von KCN aufgrund seiner hochtoxischen Natur die strikte Einhaltung von Sicherheitsprotokollen und -vorschriften erfordert.
Fragen:
F: Wie stellt man Kaliumcyanid her?
A: Die Synthese von KCN umfasst verschiedene Methoden, darunter die Reaktion von KOH mit HCN oder K2CO3 mit Ammoniumcyanid (NH4CN).
F: Was ist Kaliumcyanid?
A: Es handelt sich um eine hochgiftige Verbindung mit der chemischen Formel KCN. Es handelt sich um einen weißen kristallinen Feststoff, der im Goldabbau, in der chemischen Produktion und anderen industriellen Anwendungen verwendet wird.
F: Wo kann man in Thailand Kaliumcyanid kaufen?
A: Es ist illegal und sehr gefährlich, KCN ohne entsprechende Genehmigung oder für legitime wissenschaftliche Zwecke zu kaufen oder zu besitzen.
F: Hemmt Zyanid die Natrium-Kalium-Pumpe?
A: Ja, Cyanid hemmt die Na-K-Pumpe, stört zelluläre Prozesse und verursacht schwere Toxizität.
F: Wie stellt man Kaliumgoldcyanid her?
A: K[Au(CN)₂] wird durch Auflösen von Gold in einer KCN-haltigen Lösung hergestellt. Der Prozess umfasst Galvanisieren oder Reaktion mit KCN in Gegenwart von Sauerstoff.
F: Ist Kaliumcyanid im Rattengift enthalten?
A: KCN wird im Allgemeinen nicht in kommerziellen Rattengiften verwendet. Andere Verbindungen wie Antikoagulanzien oder Zinkphosphid werden üblicherweise zur Bekämpfung von Nagetieren eingesetzt.
F: Wie schmeckt Kaliumcyanid?
A: Es wird beschrieben, dass KCN einen bitteren Mandelgeschmack hat. Es ist jedoch hochgiftig und die Einnahme kann bereits in geringen Mengen tödlich sein.
F: Ist Kaliumcyanid giftig?
A: Ja, KCN ist extrem giftig. Es hemmt die Zellatmung, was zu Gewebeschäden, Organversagen und möglicherweise zum Tod führt.
F: Kann ich Kaliumcyanid in Großbritannien kaufen?
A: Der Kauf, Besitz oder Verkauf von KCN ohne entsprechende Genehmigung oder für legitime wissenschaftliche Zwecke ist im Vereinigten Königreich illegal und streng reguliert.
F: Was verursacht Kaliumcyanid?
A: KCN kann eine schwere Toxizität verursachen, die zu Symptomen wie Atembeschwerden, Schwindel, Übelkeit, Krämpfen und in hohen Dosen zum schnellen Tod führt.
F: Wo bekommt man Kaliumcyanid?
A: Der Erwerb von KCN ist eingeschränkt und streng reguliert. Es ist hauptsächlich von zugelassenen Chemikalienlieferanten für legitime wissenschaftliche, industrielle und Forschungszwecke erhältlich.
