Kaliumchlorat (KClO3) ist eine chemische Verbindung aus Kalium, Chlor und Sauerstoff. Aufgrund seiner oxidierenden Eigenschaften wird es häufig bei der Herstellung von Streichhölzern, Sprengstoffen und Feuerwerkskörpern verwendet.
| IUPAC-Name | Kaliumchlorid |
| Molekularformel | KClO3 |
| CAS-Nummer | 3811-04-9 |
| Synonyme | Kaliumchlorat, Chlorkalic, Kaliumchlorat, Kaliumperchlorat, UN 1485, Kaliumchlorat, Kalium perchloricum |
| InChI | InChI=1S/ClH3KO3/c2-1(3)4/h(H3,2,3,4)/p-1 |
Eigenschaften von Kaliumchlorat
Kaliumchlorat-Formel
Kaliumchlorat hat die chemische Formel KClO3, die darauf hinweist, dass es aus einem Kaliumatom, einem Chloratom und drei Sauerstoffatomen besteht. Es handelt sich um eine ionische Verbindung, die entsteht, wenn sich K+- und ClO3–Ionen über eine Ionenbindung verbinden. Aufgrund der Anwesenheit von Sauerstoff ist die Verbindung sehr reaktiv, was ihr starke oxidierende Eigenschaften verleiht.
Molmasse von Kaliumchlorat
Die Molmasse von KClO3 beträgt 122,55 g/mol. Es ist die Summe der Atommassen der einzelnen Elemente, aus denen die Verbindung besteht, nämlich Kalium, Chlor und Sauerstoff. Die Molmasse ist ein wichtiger Parameter in der Chemie, da sie zur Berechnung der Masse einer Substanz verwendet wird, die erforderlich ist, um in einer chemischen Reaktion eine bestimmte Produktmenge zu erzeugen.
Siedepunkt von Kaliumchlorat
KClO3 hat keinen genau definierten Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Beim Erhitzen zerfällt es in Kaliumchlorid und Sauerstoffgas. Daher erfährt KClO3 eine thermische Zersetzungsreaktion und keinen Siedepunkt.
Kaliumchlorat Schmelzpunkt
Der Schmelzpunkt von KClO3 beträgt 356 °C (673 °F). Bei dieser Temperatur schmilzt die feste Verbindung und wird flüssig. Der Schmelzpunkt ist eine wesentliche Eigenschaft einer Verbindung, da er das physikalische Verhalten der Substanz, einschließlich ihrer Löslichkeit und Dichte, beeinflusst.
Dichte von Kaliumchlorat g/ml
Die Dichte von KClO3 beträgt bei Raumtemperatur 2,32 g/ml. Dies bedeutet, dass ein bestimmtes Volumen der Verbindung eine bestimmte Masse hat, was bei der Bestimmung der Masse einer Substanz nützlich ist, die für eine bestimmte chemische Reaktion erforderlich ist. Die Dichte von KClO3 beeinflusst auch seine Löslichkeit in Wasser, da Verbindungen mit höherer Dichte dazu neigen, in Wasser weniger löslich zu sein.
Molekulargewicht von Kaliumchlorat
Das Molekulargewicht von KClO3 beträgt 122,55 g/mol. Es ist die Summe der Atomgewichte seiner Atombestandteile Kalium, Chlor und Sauerstoff. Das Molekulargewicht ist ein wesentlicher Parameter in der Stöchiometrie, da es zur Berechnung der Mengen von Reaktanten und Produkten in einer chemischen Reaktion verwendet wird.
Struktur von Kaliumchlorat
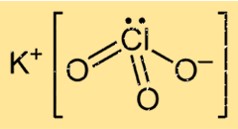
KClO3 hat in seiner festen Form eine Kristallstruktur, die aus Kalium-, Chlor- und Sauerstoffatomen besteht, die in einem bestimmten Muster angeordnet sind. Die Verbindung bildet eine flächenzentrierte kubische Kristallgitterstruktur, in der jedes Kaliumion von sechs Sauerstoffatomen und jedes Sauerstoffion von vier Kaliumatomen und zwei Chloratomen umgeben ist.
Löslichkeit von Kaliumchlorat
KClO3 ist in Wasser mäßig löslich, mit einer Löslichkeit von 7 g/100 ml Wasser bei Raumtemperatur. Die Löslichkeit der Verbindung steigt mit der Temperatur, da Wassermoleküle mehr kinetische Energie haben und mehr von der Verbindung lösen können. KClO3 ist auch in anderen polaren Lösungsmitteln wie Ethanol und Aceton löslich.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2,32 g/cm³ |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 122,55 g/Mol |
| Dichte | 2,32 g/cm³ |
| Fusionspunkt | 356°C (673°F) |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 7 g/100 ml bei 20 °C |
| Löslichkeit | Löslich in Ethanol und Aceton |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 1,8 (Ka = 1,6 × 10⁻⁵) |
| pH-Wert | Der pH-Wert einer 0,1 M Lösung beträgt etwa 6,5 bis 7,5 |
Sicherheit und Gefahren von Kaliumchlorat
KClO3 ist eine hochreaktive und potenziell gefährliche Substanz und sollte daher mit äußerster Vorsicht gehandhabt werden. Es kann schwere Haut- und Augenreizungen verursachen und bei Verschlucken oder Einatmen giftig sein. Bei Erhitzung kann es heftig reagieren und sogar explodieren. KClO3 kann auch stark mit anderen Chemikalien wie Schwefelsäure und organischen Verbindungen reagieren und giftige Gase wie Chlor und Chloratdioxid erzeugen. Bei der Arbeit mit KClO3 ist es wichtig, die richtigen Sicherheitsprotokolle einzuhalten, einschließlich des Tragens von Schutzausrüstung und des Arbeitens in einem gut belüfteten Bereich.
| Gefahrensymbole | O, Xi, N |
| Sicherheitsbeschreibung | Kontakt mit brennbaren Materialien vermeiden. Giftig beim Verschlucken. Verursacht schwere Hautverbrennungen und Augenschäden. |
| UN-Identifikationsnummern | UN1485 |
| HS-Code | 2829.90.10 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig |
Methoden zur Kaliumchlorat-Synthese
Es gibt verschiedene Methoden zur Synthese von KClO3.
Eine Methode beinhaltet die Reaktion zwischen Kaliumchlorid und Bleichmittel. Bei dieser Methode wird einer Kaliumchloridlösung eine Bleichlösung zugesetzt und die Mischung gerührt. Um KClO3 zu erhalten, filtrieren und waschen Sie den erhaltenen Niederschlag.
Eine andere Methode beinhaltet die Elektrolyse einer Lösung, die Kaliumchlorid , Wasser und eine Sauerstoffquelle enthält. Eine Elektrolysezelle, ein spezielles Gerät, führt diesen Prozess durch, indem sie Kalium- und Chloridionen trennt und Sauerstoffgas erzeugt. Sauerstoff reagiert mit Kaliumionen zu KClO3.
Eine dritte Methode beinhaltet die Reaktion zwischen Kaliumhydroxid und Chlorgas, die KClO3 mit Kaliumchlorid und Wasser ergibt. Diese Methode erfordert eine sorgfältige Kontrolle der Temperatur und Konzentration der Reagenzien, um optimale Erträge zu gewährleisten.
Verwendung von Kaliumchlorat
KClO3 hat ein breites Anwendungsspektrum in verschiedenen Branchen, darunter:
- Pyrotechnische Produkte: Wird häufig als Oxidationsmittel in Feuerwerkskörpern und anderen pyrotechnischen Geräten verwendet.
- Streichhölzer: Wird in Sicherheits-Streichholzköpfen verwendet, die sich entzünden, wenn sie gegen eine raue Oberfläche geschlagen werden.
- Dünger: Wird als Kaliumquelle für Pflanzendünger verwendet.
- Bleichmittel: Wird als Bleichmittel für Textilien, Papier und andere Materialien verwendet.
- Laborreagenz: Wird auch als Laborreagenz für verschiedene chemische Reaktionen verwendet.
- Medizinische Anwendungen: Wird medizinisch zur Behandlung bestimmter Hauterkrankungen wie Ekzemen verwendet.
- Sprengstoffe: Ein häufiger Bestandteil einiger Arten von Sprengstoffen wie Zündern und Dynamit.
- Oxidationsmittel: Wird als Oxidationsmittel bei der Herstellung bestimmter Chemikalien wie Perchloraten verwendet.
Fragen:
F: Wie viele Gramm Kaliumchlorid entstehen, wenn 25 g Kaliumchlorat zersetzt werden?
A: Wenn sich 25 g KClO3 zersetzen, entstehen 13,47 g Kaliumchlorid.
F: Wie stellt man Kaliumchlorat her?
A: KClO3 kann durch Reaktion von Kaliumchlorid mit Bleichmittel, durch Elektrolyse einer Kaliumchlorid enthaltenden Lösung oder durch Reaktion von Kaliumhydroxid mit Chlorgas hergestellt werden.
F: Wie viele Mol Sauerstoff entstehen, wenn 2 Mol Kaliumchlorat (kclo3) zersetzt werden?
A: Wenn sich 2 Mol KClO3 zersetzen, entstehen 3 Mol Sauerstoffgas.
F: Eine 0,70 m Lösung enthält 3,0 g Kaliumchlorat (kclo3). Wie groß ist das Volumen der Lösung?
A: Das Volumen der 0,70 m Lösung mit 3,0 g KClO3 beträgt 51,4 ml.
F: Ist Kaliumchlorat flüchtig?
A: KClO3 gilt nicht als flüchtige Substanz, da es einen relativ hohen Schmelz- und Siedepunkt hat.
F: Wie viel kcl entsteht, wenn man 2,50 g kclo3 zersetzt?
A: Wenn sich 2,50 g KClO3 zersetzen, entstehen 1,35 g Kaliumchlorid.
F: Ist kclo3 wasserlöslich?
A: Ja, KClO3 ist in Wasser gut löslich, mit einer Löslichkeit von 7 g/100 ml bei Raumtemperatur.
F: Wie viele Gramm Sauerstoff können durch die Zersetzung von 100 g kclo3 entstehen?
A: Wenn sich 100 g KClO3 zersetzen, entstehen 45,02 g Sauerstoffgas.
