Kaliumcarbonat (K2CO3) ist ein weißes, geruchloses Pulver, das häufig bei der Herstellung von Seife, Glas und Keramik verwendet wird. Es kann auch als Lebensmittelzusatzstoff und Puffermittel in der Pharmaindustrie verwendet werden.
| Name der IUPAC | Kaliumcarbonat |
| Molekularformel | K2CO3 |
| CAS-Nummer | 584-08-7 |
| Synonyme | Kohlensäure, Dikaliumsalz; Perlasche; Pottasche; Weinsteinsalz; Kaliummonocarbonat; Kaliumhydrogencarbonat |
| InChI | InChI=1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2/fCO3.2K/q-2; M |
Eigenschaften von Kaliumcarbonat
Kaliumcarbonat-Formel
Die chemische Formel für Kaliumcarbonat lautet K2CO3. Diese Formel gibt die genaue Anzahl der Atome jedes Elements in der Verbindung an. Mithilfe der Formel können die Molmasse und andere Eigenschaften der Verbindung berechnet werden.
Molmasse von Kaliumcarbonat
K2CO3 hat eine Molmasse von 138,21 g/mol. Das bedeutet, dass ein Mol K2CO3 138,21 Gramm der Verbindung enthält. Die Molmasse ist wichtig, um zu bestimmen, wie viel einer Substanz für eine bestimmte Reaktion oder ein bestimmtes Experiment benötigt wird. Es wird auch verwendet, um die Masse einer Substanz in Mol umzurechnen.
Siedepunkt von Kaliumcarbonat
K2CO3 hat einen relativ hohen Siedepunkt von 1.620 °C (2.948 °F). Dies macht es für Hochtemperaturanwendungen wie die Glas- und Keramikproduktion nützlich. Der Siedepunkt ist die Temperatur, bei der ein Stoff vom flüssigen in den gasförmigen Zustand übergeht.
Schmelzpunkt von Kaliumcarbonat
K2CO3 hat einen Schmelzpunkt von 891 °C (1.636 °F). Dieser relativ hohe Schmelzpunkt ist auf die ionische Natur der Verbindung zurückzuführen. Beim Erhitzen müssen die Ionenbindungen zwischen den Kalium- und Carbonationen aufgebrochen werden, damit die Substanz schmilzt.
Dichte von Kaliumcarbonat g/ml
Die Dichte von K2CO3 beträgt bei Raumtemperatur 2,43 g/ml. Das bedeutet, dass ein bestimmtes Volumen K2CO3 eine bestimmte Masse hat. Die Dichte eines Stoffes ist ein wichtiges Merkmal, das zur Identifizierung des Stoffes und zur Berechnung der Masse oder des Volumens eines Stoffes in einem bestimmten Raum verwendet werden kann.
Molekulargewicht von Kaliumcarbonat
Das Molekulargewicht von K2CO3 beträgt 138,21 g/mol. Dies ist die Masse eines Mols der Verbindung, die für viele chemische Berechnungen wichtig ist.
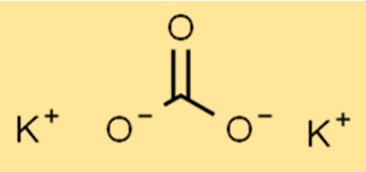
Struktur von Kaliumcarbonat
K2CO3 hat eine ionische Struktur mit der Formel K2CO3. Das Kaliumion (K+) und das Carbonation (CO32-) werden durch Ionenbindungen zusammengehalten. Das Carbonation ist ein mehratomiges Ion, das aus einem Kohlenstoffatom und drei Sauerstoffatomen besteht.
| Aussehen | weißes kristallines Pulver |
| Spezifische Dichte | 2.43 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 138,21 g/Mol |
| Dichte | 2,43 g/ml |
| Fusionspunkt | 891 °C (1.636 °F) |
| Siedepunkt | 1620 °C (2948 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 112 g/100 ml bei 20 °C |
| Löslichkeit | Löslich in Wasser, Glycerin und Alkohol |
| Dampfdruck | Bei Raumtemperatur vernachlässigbar |
| Wasserdampfdichte | Unzutreffend |
| pKa | 10:33 Uhr |
| pH-Wert | 11,5 (wässrige Lösung mit 10 g/L) |
Sicherheit und Gefahren von Kaliumcarbonat
K2CO3 gilt allgemein als sicher für die Verwendung in Industrie- und Haushaltsprodukten. Allerdings kann es Haut und Augen reizen und das Einatmen des Pulvers kann zu Reizungen der Atemwege führen. Eine längere Exposition gegenüber hohen Konzentrationen von K2CO3-Staub kann Lungenschäden verursachen. Beim Umgang mit dieser Verbindung ist es wichtig, geeignete persönliche Schutzausrüstung zu tragen, einschließlich Handschuhen, Schutzbrille und Maske. K2CO3 ist weder brennbar noch explosiv, kann jedoch mit Säuren unter Bildung von Kohlendioxid reagieren, was in geschlossenen Räumen gefährlich sein kann. Bei Verschlucken oder Kontakt mit Haut oder Augen sofort einen Arzt aufsuchen.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Tragen Sie Handschuhe, Schutzbrille und eine Maske. Längeren Kontakt mit Haut und Augen vermeiden. Das Pulver nicht einatmen. |
| UN-Identifikationsnummern | UN1863 |
| HS-Code | 2836.40.00 |
| Gefahrenklasse | Nicht gefährlich |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Kaliumcarbonat gilt nicht als giftig, kann jedoch in hohen Konzentrationen Reizungen der Atemwege und der Haut verursachen. Eine längere Exposition gegenüber hohen Staubkonzentrationen kann zu Lungenschäden führen. |
Methoden zur Kaliumcarbonat-Synthese
Verschiedene Methoden können K2CO3 synthetisieren
Eine übliche Methode ist die Reaktion von Kaliumhydroxid mit Kohlendioxid.
Um den Austritt von Kohlendioxid zu verhindern, kann diese Reaktion in einem geschlossenen Behälter durchgeführt werden.
Eine andere Methode besteht darin, Kaliumchlorid mit Natriumcarbonat in einer wässrigen Lösung umzusetzen. Das entstehende K2CO3 fällt aus der Lösung aus und kann durch Filtration gesammelt werden.
Eine andere Möglichkeit, K2CO3 zu synthetisieren, besteht darin, Kaliumsulfat mit Kohlenstoff in Gegenwart von Aktivkohle umzusetzen. Historisch gesehen nutzten Chemiker das Leblanc-Verfahren zur Herstellung von K2CO3 im industriellen Maßstab. Aufgrund von Umweltbedenken ist dieser Prozess jedoch heute selten geworden, da dabei Schwefeldioxid freigesetzt wird.
K2CO3 kann aus Kaliumbicarbonat synthetisiert werden, indem es auf hohe Temperaturen erhitzt wird, wodurch es in K2CO3 und Kohlendioxid zerfällt. Ein Ofen oder Ofen kann diese Reaktion durchführen.
Verwendung von Kaliumcarbonat
Aufgrund seiner einzigartigen Eigenschaften findet K2CO3 ein breites Anwendungsspektrum in verschiedenen Branchen. Zu den häufigsten Verwendungszwecken gehören:
- Glasherstellung: Wird als Flussmittel verwendet, um den Schmelzpunkt von Kieselsäure und anderen Inhaltsstoffen zu senken.
- Lebensmittelindustrie: Wird als Lebensmittelzusatz zur Regulierung des Säuregehalts und als Backmittel beim Backen verwendet.
- Seife und Reinigungsmittel: Wird auch bei der Herstellung von Seifen und Reinigungsmitteln als Wasserenthärter verwendet.
- Pharmazeutische Industrie: Wird als Puffermittel bei der Arzneimittelformulierung verwendet.
- Dünger: Wird auch als Dünger in der Landwirtschaft verwendet, um Pflanzen mit Kalium zu versorgen.
- Keramikproduktion: Wird als Flussmittel verwendet, um die Brenntemperatur zu senken und die Qualität des Endprodukts zu verbessern.
- Feuerwerk: Wird bei der Herstellung von Feuerwerkskörpern verwendet, um eine violette Flamme zu erzeugen.
- Batterien: Wird bei der Herstellung von Batterien als Elektrolyt verwendet.
- Textilindustrie: Wird als Färbemittel verwendet.
Fragen:
F: Ist Kaliumcarbonat löslich?
A: Ja, Kaliumcarbonat ist wasserlöslich.
F: Ist K2CO3 wasserlöslich?
A: Ja, K2CO3 ist wasserlöslich. Tatsächlich ist es sehr gut löslich und kann sich in Wasser auflösen und eine klare, farblose Lösung bilden.
F: Wie viele Gramm Kaliumcarbonat werden benötigt, um 200 ml einer 2,5 M Lösung herzustellen?
A: Um eine Lösung von 2,5 M K2CO3 in 200 ml Wasser herzustellen, müssen Sie 33,25 Gramm K2CO3 in Wasser auflösen.
Berechnung: Molarität = Mol / Volumen (in Litern) 2,5 M = Mol / 0,2 L Mol = 0,5 Mol Masse = Mol x Molmasse Masse = 0,5 Mol x 138,21 g/Mol Masse = 33,25 g
F: Wie hoch ist die Konzentration von K-Ionen in einer 0,045 M K2CO3-Lösung unter der Annahme einer vollständigen Dissoziation?
A: Wenn K2CO3 in Wasser vollständig dissoziiert ist, bildet es zwei K+-Ionen und ein CO3 2–Ion. Daher wäre die Konzentration von K+-Ionen in einer 0,045 M K2CO3-Lösung doppelt so hoch wie die Molarität der K2CO3-Lösung, die 0,090 M beträgt.
