Kaliumbisulfit ist eine chemische Verbindung. Es hat die Formel KHSO3. Es wirkt als Konservierungsmittel und Antioxidans in Lebensmitteln und Wein.
| Name der IUPAC | Kaliumhydrogensulfit |
| Molekularformel | KHSO3 |
| CAS-Nummer | 7773-03-7 |
| Synonyme | Kaliumbisulfit, Kaliumbisulfit, Monokaliumsalz, Monokaliumsulfit, Kaliumhydrosulfit |
| InChI | InChI=1S/K.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+1;/p-1 |
Eigenschaften von Kaliumbisulfit
Kaliumbisulfit-Formel
Die Formel für Kaliumbisulfit lautet KHSO3. Diese Formel zeigt das Verhältnis von Kalium-, Wasserstoff-, Schwefel- und Sauerstoffatomen in einer Einheit Kaliumbisulfit. Die Formel kann auch als KH(SO3) geschrieben werden, was zeigt, dass Kaliumbisulfit ein Salz aus Kalium und schwefliger Säure (H2SO3) ist.
Molmasse von Kaliumbisulfit
Die Molmasse von Kaliumbisulfit beträgt 120,1694 g/mol. Das bedeutet, dass ein Mol Kaliumbisulfit eine Masse von 120,1694 Gramm hat. Die Molmasse wird durch Addition der Atommassen von Kalium, Wasserstoff, Schwefel und Sauerstoff in der Formel KHSO3 berechnet.
Siedepunkt von Kaliumbisulfit
KHSO3 hat keinen definierten Siedepunkt, da es sich vor Erreichen des Siedepunkts zersetzt. Beim Erhitzen über 190 °C zerfällt KHSO3 in Kaliummetabisulfit und Wasser. Die Zersetzungsreaktion ist endotherm, das heißt, sie nimmt Wärme aus der Umgebung auf.
Schmelzpunkt von Kaliumbisulfit
KHSO3 hat einen Schmelzpunkt von 190 °C, die gleiche Temperatur, bei der es sich zersetzt. Daher liegt KHSO3 unter normalen Bedingungen nicht in flüssiger Form vor. Es ist ein weißer kristalliner Feststoff, der sich in Wasser löst.
Kaliumbisulfit Dichte g/ml
Die Dichte von KHSO3 beträgt 2,103 g/ml bei 20 °C. Das bedeutet, dass ein Milliliter KHSO3 eine Masse von 2,103 Gramm hat. Die Dichte wird durch die Temperatur und Konzentration der Lösung beeinflusst.
Molekulargewicht von Kaliumbisulfit
Das Molekulargewicht von KHSO3 entspricht seiner Molmasse, die 120,1694 g/mol beträgt. Das Molekulargewicht ist die Masse eines KHSO3-Moleküls, die sehr klein ist und nicht direkt gemessen werden kann. Das Molekulargewicht ist nützlich, um die Anzahl der Moleküle in einer bestimmten Masse oder einem bestimmten Volumen einer Substanz zu berechnen.
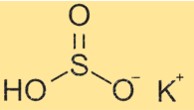
Struktur von Kaliumbisulfit
KHSO3 hat eine Struktur bestehend aus K+- und HSO3–Ionen. Das Bisulfit-Ion hat eine tetraedrische Form mit einem Wasserstoffatom und drei Sauerstoffatomen, die an ein zentrales Schwefelatom gebunden sind. Das Schwefelatom hat eine Doppelbindung mit einem Sauerstoffatom und eine Einfachbindung mit den anderen beiden Sauerstoffatomen. Das Wasserstoffatom ist an eines der einfach gebundenen Sauerstoffatome gebunden.
Löslichkeit von Kaliumbisulfit
KHSO3 ist eine chemische Mischung, die sich in Wasser unter Bildung von Kaliumionen und Bisulfit-Ionen löst. Es hat einen schwefeligen Geruch und ein weißes, festes Aussehen. Es ist wasserlöslich und hat eine Löslichkeit von 49 g/100 ml bei 20 °C. Es wird als Sterilisationsmittel bei der Herstellung alkoholischer Getränke verwendet.
| Aussehen | weißes kristallines Pulver |
| Spezifische Dichte | 2.103 |
| Farbe | Weiß |
| Geruch | typisches SO2 |
| Molmasse | 120,1694 g/Mol |
| Dichte | 2,103 g/ml bei 20°C |
| Fusionspunkt | 190°C (zersetzt sich) |
| Siedepunkt | N/A (zerlegt) |
| Blitzpunkt | N / A |
| Löslichkeit in Wasser | 49 g/100 ml bei 20 °C |
| Löslichkeit | Unlöslich in Alkohol |
| Dampfdruck | N / A |
| Wasserdampfdichte | N / A |
| pKa | 6,97 bei 25°C |
| pH-Wert | 4,5 (0,1 M Lösung) |
Sicherheit und Gefahren von Kaliumbisulfit
KHSO3 ist eine ätzende Substanz, die schwere Hautverbrennungen und Augenschäden verursachen kann. Es kann außerdem zu Reizungen der Atemwege und Verbrennungen im Verdauungstrakt führen, wenn es eingeatmet oder verschluckt wird. Es ist feuchtigkeitsempfindlich und setzt bei der Reaktion mit Säuren giftiges Schwefeldioxid frei. Es muss mit Vorsicht und mit geeigneter persönlicher Schutzausrüstung gehandhabt werden. Es sollte an einem trockenen, gut belüfteten Ort gelagert werden, fern von Hitze, Funken, Flammen und unverträglichen Materialien. Es muss gemäß den örtlichen Vorschriften entsorgt werden. Bei Exposition sofort einen Arzt aufsuchen und die im Sicherheitsdatenblatt angegebenen Erste-Hilfe-Maßnahmen befolgen.
| Gefahrensymbole | C (ätzend) |
| Sicherheitsbeschreibung | S26: Bei Augenkontakt sofort mit viel Wasser ausspülen und einen Arzt aufsuchen. S36/37/39: Geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz tragen. S45: Bei Unfall oder Unwohlsein sofort Arzt hinzuziehen (wenn möglich, dieses Etikett vorzeigen). |
| UN-Identifikationsnummern | UN 3260 |
| HS-Code | 2832 10 00 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | II |
| Toxizität | Oraler LD50 (Ratte): 2340 mg/kg |
Methoden zur Kaliumbisulfit-Synthese
Hier sind einige Methoden zur Synthese von KHSO3:
- Eine Methode beinhaltet die Reaktion mit Schwefeldioxid und Kaliumcarbonat in einer Lösung. Um KHSO3-Kristalle zu erhalten, leiten Sie Schwefeldioxid durch die Lösung, bis kein Kohlendioxid mehr entsteht, und konzentrieren Sie dann die Lösung.
- Eine andere Methode beinhaltet die Reaktion mit Kaliumchlorid und Schwefelsäure in einer Lösung. Bei der Reaktion entstehen Chlorwasserstoff und KHSO3. Nach dem Abkühlen wird die Lösung aktiv filtriert, um das feste KHSO3 abzutrennen.
- Eine dritte Methode beinhaltet die Reaktion mit Kaliumhydroxid und Schwefelsäure in einer Lösung. Bei der Reaktion entstehen Wasser und KHSO3. Zur Reinigung des KHSO3 kann die Lösung umkristallisiert werden.
Verwendung von Kaliumbisulfit
Hier sind einige Verwendungsmöglichkeiten von KHSO3:
- Sterilisationsmittel: Wird als Sterilisationsmittel bei der Herstellung alkoholischer Getränke verwendet. Es verhindert das Wachstum von Bakterien und Pilzen, die Wein oder Bier verderben könnten.
- Konservierungsmittel: Wird als Konservierungsmittel und Antioxidans in Lebensmitteln verwendet. Es hemmt die Bräunung und Oxidation von Obst, Gemüse, Säften, Soßen und getrockneten Lebensmitteln.
- Reduktionsmittel: Wird in der organischen Chemie als Reduktionsmittel verwendet. Es kann Aldehyde, Ketone, Nitrogruppen, Sulfone und Sulfoxide zu ihren entsprechenden Alkoholen, Aminen, Sulfiden und Sulfiden reduzieren.
- Bleichmittel: Wird als Bleichmittel in der Textil- und Papierindustrie verwendet. Es kann Farbe und Flecken aus Gewebe und Fruchtfleisch entfernen.
- Wird in verschiedenen Anwendungen als Schwefeldioxidquelle verwendet. Beim Erhitzen oder Mischen mit Säuren kann Schwefeldioxid freigesetzt werden. Schwefeldioxid ist ein Begasungsmittel, Desinfektionsmittel, Lösungsmittel und Katalysator.
Fragen:
F: Wie viel Kaliumbisulfit sollte desinfiziert werden?
A: Die für die Desinfektion benötigte Menge an KHSO3 hängt von der Konzentration der Lösung und den spezifischen Mikroorganismen ab, auf die es abzielt. Es wird empfohlen, die Anweisungen auf dem Produktetikett zu befolgen oder sich von einem qualifizierten Fachmann beraten zu lassen.
F: Wie lautet die Formel für Kaliumbisulfit?
A: Die chemische Formel für Kaliumbisulfit lautet KHSO3.
F: Ist Kaliumbisulfit sicher?
A: KHSO3 ist im Allgemeinen sicher, wenn es gemäß den Anweisungen verwendet wird. Es kann jedoch zu Reizungen der Haut, der Augen und der Atemwege führen. Bei manchen Menschen kann es auch allergische Reaktionen hervorrufen. Es ist wichtig, KHSO3 richtig zu handhaben und zu lagern und gegebenenfalls Schutzausrüstung zu verwenden.
F: Wie lange ist Kaliumbisulfit haltbar?
A: Die Haltbarkeit von KHSO3 hängt von verschiedenen Faktoren wie Lagerbedingungen, Konzentration und Reinheit des Produkts ab. Im Allgemeinen ist es mehrere Jahre haltbar, wenn es an einem kühlen, trockenen Ort in einem gut verschlossenen Behälter gelagert wird.
F: Wie reagieren NaHSO3 und Kaliumjodat, um eine Jodreaktion mit Stärkegleichungen hervorzurufen?
A: Durch die Reaktion von NaHSO3 und Kaliumjodat entsteht Jod, das dann mit Stärke reagieren kann und einen blauschwarzen Komplex bildet. Die Reaktionsgleichungen lauten: 5NaHSO3 + KIO3 → 5NaHSO4 + KI + 3H2O + I2 I2 + Stärke → blauschwarzer Komplex
