Kaliumbikarbonat (KHCO3) dient als weißes kristallines Salz und wird häufig als Trennmittel beim Backen, als Feuerlöschmittel und zur Neutralisierung des Bodensäuregehalts in der Landwirtschaft verwendet. Darüber hinaus dient es als Nahrungsergänzungsmittel und spielt bei bestimmten medizinischen Behandlungen eine Rolle.
| IUPAC-Name | Kaliumhydrogencarbonat |
| Molekularformel | KHCO3 |
| CAS-Nummer | 298-14-6 |
| Synonyme | Kaliumhydrogencarbonat, Kaliumsäuresalz, Kaliumhydrogencarbonat, PCN 0775, E501 |
| InChI | InChI=1S/CH2O3.K/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 |
Eigenschaften von Kaliumbicarbonat
Kaliumbikarbonat-Formel
Die Formel für Kaliumbicarbonat lautet KHCO3. Diese Formel gibt an, dass ein Kaliumion (K+) mit einem Bicarbonat-Ion (HCO3-) kombiniert wird, um ein Kaliumbicarbonat-Molekül zu bilden. Die Formel ist in der Chemie wichtig, weil sie Auskunft über die Art und Anzahl der Atome gibt, aus denen ein Molekül besteht.
Molmasse von Kaliumbicarbonat
KHCO3 hat eine Molmasse von 100,115 g/mol. Das bedeutet, dass ein Mol KHCO3 100,115 Gramm der Verbindung enthält. Die Molmasse ist eine wichtige Eigenschaft einer Verbindung, da sie zur Berechnung der Menge einer Substanz verwendet wird, die für eine chemische Reaktion benötigt wird. Darüber hinaus kann die Molmasse zur Umrechnung von Gramm und Mol einer Substanz verwendet werden.
Siedepunkt von Kaliumbicarbonat
Der Siedepunkt von KHCO3 ist nicht genau definiert, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Beim Erhitzen zerfällt KHCO3 in Kaliumcarbonat, Kohlendioxid und Wasser. Daher wird die Zersetzungstemperatur von KHCO3 zur Beschreibung seiner thermischen Stabilität verwendet.
Schmelzpunkt von Kaliumbicarbonat
KHCO3 hat einen Schmelzpunkt von 292 °C. Bei dieser Temperatur geht KHCO3 vom festen in den flüssigen Zustand über. Der Schmelzpunkt einer Verbindung ist eine wichtige physikalische Eigenschaft, da er die Bedingungen bestimmt, unter denen die Verbindung geschmolzen und verarbeitet werden kann.
Dichte von Kaliumbicarbonat g/ml
Die Dichte von KHCO3 beträgt 2,17 g/ml. Die Dichte ist ein Maß für die Menge an Masse pro Volumeneinheit. Die hohe Dichte von KHCO3 macht es zu einer nützlichen Verbindung in Anwendungen wie Feuerlöschern, wo es zum Löschen von Bränden der Klasse B eingesetzt wird.
Molekulargewicht von Kaliumbicarbonat
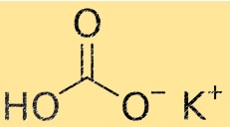
Das Molekulargewicht von KHCO3 beträgt 100,115 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül. Diese Eigenschaft ist in der Chemie wichtig, da sie zur Berechnung der Menge eines Stoffes verwendet wird, die für eine chemische Reaktion benötigt wird.
Struktur von Kaliumbicarbonat
KHCO3 hat eine ähnliche Kristallstruktur wie Natriumchlorid. Die Verbindung besteht aus Kaliumionen (K+) und Bicarbonationen (HCO3-). Kaliumionen nehmen in der Kristallstruktur von Natriumchlorid die Positionen von Natriumionen ein, während Bicarbonationen die Positionen von Chloridionen einnehmen.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 2,17 g/cm³ |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 100,115 g/Mol |
| Dichte | 2,17 g/cm³ |
| Fusionspunkt | 292°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 25g/100ml (20°C) |
| Löslichkeit | In Wasser löslich |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 10,3 (Kohlensäure) |
| pH-Wert | 8,5 – 9,5 (1%ige Lösung) |
Sicherheit und Gefahren von Kaliumbicarbonat
KHCO3 gilt im Allgemeinen als sicher, wenn es bestimmungsgemäß verwendet wird. Es kann jedoch zu Haut- und Augenreizungen führen und sollte daher mit Vorsicht gehandhabt werden. Es kann auch schädlich sein, wenn es in großen Mengen eingenommen wird. Das Einatmen von Staub kann zu Reizungen der Atemwege führen. Darüber hinaus kann es mit starken Säuren reagieren und Kohlendioxid freisetzen, was gefährlich sein kann. Bei der Verwendung von KHCO3 ist es wichtig, Sicherheitsverfahren zu befolgen und geeignete Schutzausrüstung zu tragen. Bei Verschlucken sofort einen Arzt aufsuchen. Bei Haut- oder Augenkontakt die betroffene Stelle gründlich mit Wasser waschen und bei anhaltender Reizung einen Arzt aufsuchen.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Gesundheitsschädlich beim Verschlucken, verursacht Haut- und Augenreizungen. Einatmen vermeiden. |
| UN-Identifikationsnummern | UN 2987 |
| HS-Code | 2836.30.00 |
| Gefahrenklasse | 8 (ätzend) |
| Verpackungsgruppe | III |
| Toxizität | LD50 (Ratte, oral): 6.400 mg/kg |
Methoden zur Synthese von Kaliumbicarbonat
In Gegenwart von Wasser reagiert Kohlendioxid mit Kaliumcarbonat unter Bildung von KHCO3.
Die Reaktion läuft wie folgt ab:
K2CO3 + CO2 + H2O → 2KHCO3
Eine andere Methode besteht darin , Kaliumhydroxid mit Kohlendioxid umzusetzen:
KOH + CO2 → KHCO3
Das resultierende KHCO3 kann dann durch Umkristallisation aus Wasser gereinigt werden. Die Reaktionsausbeute hängt von der Reinheit der Rohstoffe und den Reaktionsbedingungen ab.
Zur Herstellung von KHCO3 kann Kaliumchlorid mit Ammoniumbicarbonat umgesetzt und anschließend mit Kohlendioxid behandelt werden.
NH4HCO3 + KCl → NH4Cl + KHCO3
KHCO3 + CO2 → K2CO3 + H2O
K2CO3 + CO2 + H2O → 2KHCO3
Diese Methode hat den Vorteil, dass kostengünstige Rohstoffe verwendet werden und keine gefährlichen Nebenprodukte entstehen.
Verwendung von Kaliumbikarbonat
KHCO3 hat ein breites Einsatzspektrum in verschiedenen Branchen und Anwendungen. Hier sind einige der häufigsten Verwendungszwecke:
- Lebensmittelindustrie: Wird als Backtriebmittel in Backwaren wie Kuchen, Keksen und Brot verwendet, um ihnen das Aufgehen zu erleichtern.
- Landwirtschaft: Wird als Fungizid zur Bekämpfung von Pilzkrankheiten wie Mehltau eingesetzt.
- Arzneimittel: Wird in Antazida zur Neutralisierung der Magensäure und zur Behandlung von Verdauungsstörungen und Sodbrennen verwendet.
- Feuerlöscher: Wird in Feuerlöschern als trockenes chemisches Mittel zum Löschen von Bränden der Klassen B und C verwendet.
- Laboranwendungen: Wird in verschiedenen Laboranwendungen verwendet, wie z. B. pH-Pufferung und Zellkultur.
- Körperpflegeprodukte: Werden in Zahnpasten als milde Schleifmittel und in Deodorants zur Geruchskontrolle verwendet.
- Wasseraufbereitung: Wird bei der Wasseraufbereitung verwendet, um den pH-Wert anzupassen und Schwermetalle und andere Verunreinigungen zu entfernen.
Fragen:
F: Was ist Kaliumbicarbonat?
A: KHCO3 ist ein weißes, geruchloses Pulver, das häufig in verschiedenen Branchen wie der Lebensmittel-, Landwirtschafts- und Pharmaindustrie verwendet wird. Es hat die chemische Formel KHCO3 und ist ein Salz, das aus Kaliumkationen, Bicarbonatanionen und Wassermolekülen besteht.
F: Verwandelt sich das Bikarbonat in Kalium-Brausetabletten in Kohlendioxid?
A: Ja, wenn sich Kalium-Brausetabletten in Wasser auflösen, reagiert das Bikarbonat in der Tablette mit Zitronensäure unter Freisetzung von Kohlendioxid. Diese Reaktion erzeugt das charakteristische Zischen und Blasenbilden, das bei Brausetabletten auftritt.
F: Was passiert nach der Zugabe von Kaliumbicarbonat zum Wein?
HAT: Die Zugabe von KHCO3 zum Wein verringert den Säuregehalt des Weins, indem es mit der überschüssigen vorhandenen Säure reagiert. Winzer nutzen diesen Prozess, der als Entsäuerung bezeichnet wird, häufig, um den Geschmack und die Qualität des Weins zu verbessern.
F: Wo kann man Kaliumbikarbonat kaufen?
A: KHCO3 kann bei verschiedenen Chemielieferanten, Online-Marktplätzen und Agrarfachgeschäften erworben werden. Es ist auch häufig in Reformhäusern und Reformhäusern erhältlich.
F: Wie heißt die Verbindung mit der Formel KHCO3?
A: Die Verbindung mit der Formel KHCO3 heißt Kaliumbicarbonat.
F: Was wurde im Experiment getan, um sicherzustellen, dass das gesamte KHCO3 reagiert hatte?
A: Um sicherzustellen, dass das gesamte KHCO3 reagiert hatte, wurde im Experiment der Reaktionsmischung überschüssige Säure zugesetzt und die Reaktion fortgesetzt, bis kein Gas mehr erzeugt wurde. Das Fehlen von Gas deutete darauf hin, dass das gesamte KHCO3 mit der Säure reagiert hatte.
F: Was passiert, wenn Sie KHCO3 erhitzen?
A: Wenn KHCO3 erhitzt wird, zersetzt es sich und bildet Kaliumcarbonat (K2CO3), Wasser und Kohlendioxid. Diese Reaktion läuft wie folgt ab: 2KHCO3 → K2CO3 + H2O + CO2.
