Kaliumacetat (C2H3KO2) ist eine Verbindung aus Kalium, Kohlenstoff, Wasserstoff und Sauerstoff. Es wird in der Lebensmittelindustrie häufig als Konservierungsmittel und als Enteisungsmittel für Start- und Landebahnen von Flughäfen verwendet.
| Name der IUPAC | Kaliumacetat |
| Molekularformel | C2H3KO2 |
| CAS-Nummer | 127-08-2 |
| Synonyme | KAc, Kaliumethanoat |
| InChI | InChI=1S/C2H4O2.K/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
Eigenschaften von Kaliumacetat
Kaliumacetat-Formel
Die chemische Formel für Kaliumacetat lautet C2H3KO2. Es besteht aus einem K+-Ion und einem CH3COO–Ion. Das Acetation ist mehratomig, das heißt, es besteht aus mehreren miteinander verbundenen Atomen. Im Fall von Acetat besteht es aus zwei Kohlenstoffatomen, drei Wasserstoffatomen und zwei Sauerstoffatomen.
Molmasse von Kaliumacetat
C2H3KO2 hat eine Molmasse von 98,14 g/mol. Die Molmasse ist die Masse eines Mols einer Substanz und wird durch Addition der Atommassen aller Atome in einem Molekül berechnet. Im Fall von C2H3KO2 werden die Atommassen von Kalium, Kohlenstoff, Wasserstoff und Sauerstoff addiert, um die Molmasse zu erhalten.
Siedepunkt von Kaliumacetat
Der Siedepunkt von C2H3KO2 beträgt 881 °C (1618 °F). Der Siedepunkt ist die Temperatur, bei der ein Stoff vom flüssigen in den gasförmigen Zustand übergeht. C2H3KO2 hat im Vergleich zu anderen Verbindungen einen relativ hohen Siedepunkt, was auf seine ionische Natur und die starke Anziehung zwischen positiv geladenen Kaliumionen und negativ geladenen Acetationen zurückzuführen ist.
Kaliumacetat Schmelzpunkt
Der Schmelzpunkt von C2H3KO2 beträgt 292 °C (558 °F). Der Schmelzpunkt ist die Temperatur, bei der ein Feststoff flüssig wird. C2H3KO2 hat einen relativ hohen Schmelzpunkt, was auf seine ionische Natur und die starke Anziehung zwischen positiv geladenen Kaliumionen und negativ geladenen Acetationen zurückzuführen ist.
Dichte von Kaliumacetat g/ml
Die Dichte von C2H3KO2 beträgt 1,57 g/ml. Die Dichte ist die Masse pro Volumeneinheit eines Stoffes. Die relativ hohe Dichte von C2H3KO2 ist auf seinen ionischen Charakter und die kompakte Anordnung der Ionen in seinem Kristallgitter zurückzuführen.
Molekulargewicht von Kaliumacetat
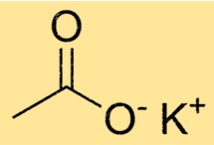
Das Molekulargewicht von C2H3KO2 beträgt 98,14 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül. Im Fall von C2H3KO2 ist es die Summe der Atomgewichte von Kalium, Kohlenstoff, Wasserstoff und Sauerstoff.
Struktur von Kaliumacetat
C2H3KO2 hat eine ionische Kristallstruktur. Es besteht aus positiv geladenen K+-Ionen und negativ geladenen CH3COO–Ionen. Acetat-Ionen sind in einer Ebene angeordnet, wobei jedes Kohlenstoffatom an ein Sauerstoffatom und ein Wasserstoffatom gebunden ist. Kaliumionen befinden sich zwischen den Ebenen der Acetationen und bilden ein dreidimensionales Kristallgitter.
| Aussehen | weißes kristallines Pulver |
| Spezifische Dichte | 1,57 g/cm3 |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 98,14 g/Mol |
| Dichte | 1,57 g/ml |
| Fusionspunkt | 292 °C (558 °F) |
| Siedepunkt | 881 °C (1618 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr gut wasserlöslich |
| Löslichkeit | Löslich in Ethanol und Methanol |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 4,76 |
| pH-Wert | 7 (10 % wässrige Lösung) |
Sicherheit und Gefahren von Kaliumacetat
C2H3KO2 gilt im Allgemeinen als sicher für den menschlichen Gebrauch, weist eine geringe Toxizität auf und weist keine bekannten krebserzeugenden oder mutagenen Wirkungen auf. Es kann jedoch zu Reizungen der Haut und der Augen führen und eine längere oder wiederholte Exposition kann zu Dermatitis führen. Außerdem reizt es leicht die Atemwege und kann bei Einatmen großer Mengen Husten oder Atemnot verursachen. Bei Verschlucken kann es zu Magen-Darm-Reizungen, Übelkeit und Erbrechen kommen. Darüber hinaus kann C2H3KO2 mit bestimmten Chemikalien reagieren und gefährliche Nebenprodukte wie Essigsäure oder Kaliumhydroxid erzeugen. Es muss daher sorgfältig gehandhabt und entsprechend gelagert werden, um den Kontakt mit unverträglichen Substanzen zu vermeiden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Von Hitze, Funken und Flammen fernhalten. Verschlucken, Einatmen und Kontakt mit Haut und Augen vermeiden. Tragen Sie Handschuhe und Schutzbrille. |
| EINE ID | UN2923 |
| HS-Code | 2915.29.10 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | III |
| Toxizität | Geringe Toxizität. Kann Haut, Augen und Atemwege reizen. Beim Verschlucken kann es zu Magen-Darm-Reizungen, Übelkeit und Erbrechen kommen. |
Methoden zur Kaliumacetat-Synthese
Um C2H3KO2 zu synthetisieren, muss man Kaliumhydroxid mit Essigsäure neutralisieren, Kaliumcarbonat mit Essigsäure reagieren lassen oder Kaliummetall mit Essigsäure reagieren lassen.
Bei der Neutralisationsmethode wird Essigsäure langsam zu einer Kaliumhydroxidlösung gegeben, bis der pH-Wert einen neutralen Wert erreicht. Dieser Prozess führt zur Bildung von C2H3KO2 und Wasser. Dann verdampft der Experimentator die resultierende Lösung und erhält einen weißen kristallinen Feststoff aus C2H3KO2.
Bei dieser Methode erfordert der Prozess das vollständige Erhitzen einer Mischung aus Essigsäure und Kaliumcarbonat . Anschließend wird die Mischung filtriert, um die restlichen Feststoffe zu entfernen, dann eingedampft und kristallisiert, um C2H3KO2 zu erhalten.
Die Reaktion von Kaliummetall mit Essigsäure ist eine weitere Methode zur Synthese von C2H3KO2. Bei diesem Verfahren wird einer Essigsäurelösung metallisches Kalium zugesetzt, wodurch C2H3KO2 und Wasserstoffgas entstehen. Anschließend ermöglicht das Eindampfen der Lösung und das Kristallisieren des C2H3KO2 dessen Extraktion.
Verwendung von Kaliumacetat
C2H3KO2 hat ein breites Anwendungsspektrum in verschiedenen Branchen, darunter:
Enteisungsmittel: Wird häufig als Enteisungsmittel auf Landebahnen, Brücken und anderen Oberflächen von Flughäfen verwendet, wo herkömmliche Enteisungsmittel auf Salzbasis die Umwelt schädigen können.
Lebensmittelkonservierungsmittel: Wird als Lebensmittelkonservierungsmittel verwendet, um den Verderb zu verhindern und die Haltbarkeit bestimmter Lebensmittel zu verlängern.
Puffermittel: Wird als Puffermittel in verschiedenen Branchen eingesetzt, darunter in der Pharma-, Textil- und Kosmetikindustrie.
Katalysator: Wird als Katalysator bei der Herstellung bestimmter Chemikalien wie Essigsäureanhydrid verwendet.
Laborreagenz: Ein gängiges Laborreagenz für verschiedene Analyse- und Forschungszwecke.
Tierfutterzusatz: Wird als Futterzusatz für Nutztiere verwendet, insbesondere in der Geflügel- und Schweineernährung, um das Wachstum und die allgemeine Gesundheit zu verbessern.
Flammhemmend: Wird in einigen Kunststoffen und Textilien als Flammschutzmittel verwendet, um die Brandgefahr zu verringern.
Medizinische Anwendungen: Wird auch in einigen medizinischen Anwendungen verwendet, beispielsweise zur Behandlung von Hypokaliämie (niedriger Kaliumspiegel) und als Bestandteil einiger Dialyselösungen.
Fragen:
F: Ist Kaliumacetat löslich?
A: Ja, C2H3KO2 ist wasserlöslich.
F: Wie lautet die Formel für Kaliumacetat?
A: Die Formel für Kaliumacetat lautet CH3CO2K.
F: Wofür wird Kaliumacetat verwendet?
A: C2H3KO2 wird für verschiedene Zwecke verwendet, darunter als Enteisungsmittel, Lebensmittelkonservierungsmittel, Puffermittel, Katalysator, Laborreagenz, Tierfutterzusatzstoff, Flammschutzmittel und in einigen medizinischen Anwendungen.
F: Ist Kaliumacetat wasserlöslich?
A: Ja, C2H3KO2 ist wasserlöslich.
F: Ist Kaliumacetat eine Säure oder eine Base?
A: C2H3KO2 ist weder eine Säure noch eine Base, kann aber als Puffer wirken und dabei helfen, einen stabilen pH-Wert in Lösungen aufrechtzuerhalten.
