Jodwasserstoffsäure (HI) ist eine starke Säure, die aus Wasserstoff und Jod gebildet wird. Es wird in der organischen Synthese und als Reduktionsmittel verwendet. Es ist sehr ätzend und erfordert eine sorgfältige Handhabung.
| IUPAC-Name | Jodwasserstoffsäure |
| Molekularformel | HALLO |
| CAS-Nummer | 10034-85-2 |
| Synonyme | Jodwasserstoffsäure, Jodwasserstoff, Jodan |
| InChI | InChI=1S/HI/h1H |
Eigenschaften von Jodwasserstoffsäure
Formel für Jodwasserstoffsäure
Die chemische Formel für Jodwasserstoff ist HI. Es besteht aus einem Wasserstoffatom (H), das an ein Jodatom (I) gebunden ist. Diese einfache Formel stellt die Zusammensetzung dieser starken Säure dar.
Molmasse der Iodwasserstoffsäure
Die Molmasse von Jodwasserstoff (HI) beträgt etwa 127,91 Gramm pro Mol (g/mol). Dieser Wert wird durch Addition der Atommassen eines Wasserstoffatoms und eines Jodatoms berechnet.
Siedepunkt von Jodwasserstoffsäure
Jodwasserstoff hat einen relativ niedrigen Siedepunkt, etwa -35 Grad Celsius (-31 Grad Fahrenheit). Bei dieser Temperatur geht die flüssige Form von HI in den gasförmigen Zustand über.
Jodwasserstoffsäure Schmelzpunkt
Der Schmelzpunkt von Jodwasserstoff liegt bei etwa -51 Grad Celsius (-60 Grad Fahrenheit). Bei dieser Temperatur geht die feste Form von HI in einen flüssigen Zustand über.
Dichte von Jodwasserstoffsäure g/ml
Die Dichte von Jodwasserstoff beträgt etwa 2,85 Gramm pro Milliliter (g/ml). Diese Dichtemessung gibt die Masse an HI an, die in einem Milliliter der Substanz vorhanden ist.
Molekulargewicht der Jodwasserstoffsäure
Jodwasserstoff hat ein Molekulargewicht von etwa 127,91 g/mol. Dieser Wert ist die Summe der Atomgewichte von Wasserstoff und Jod im HI-Molekül.
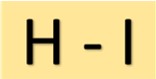
Struktur von Jodwasserstoffsäure
Iodwasserstoffsäure (HI) hat eine einfache Struktur. Es besteht aus einem Wasserstoffatom, das über eine einzelne kovalente Bindung mit einem Jodatom verbunden ist. Diese molekulare Anordnung verleiht HI seine charakteristischen Eigenschaften.
Löslichkeit von Jodwasserstoffsäure
Iodwasserstoffsäure hat eine hohe Löslichkeit in Wasser. Beim Mischen mit Wasser löst es sich leicht auf und bildet eine farblose Lösung. Seine hohe Löslichkeit trägt zu seiner weit verbreiteten Verwendung in verschiedenen Anwendungen, einschließlich der chemischen Synthese, bei.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 2,85 g/ml |
| Farbe | Farblos |
| Geruch | Acre |
| Molmasse | 127,91 g/Mol |
| Dichte | 2,85 g/ml |
| Fusionspunkt | -51 °C (-60 °F) |
| Siedepunkt | -35°C (-31°F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Mischbar, Bildung einer farblosen Lösung |
| Löslichkeit | Löslich in organischen Lösungsmitteln |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | -zehn |
| pH-Wert | Sehr sauer (pH < 1) |
Sicherheit und Gefahren von Jodwasserstoffsäure
Jodwasserstoff (HI) birgt aufgrund seiner ätzenden Natur erhebliche Sicherheitsrisiken. Bei Kontakt kann es zu schweren Hautverbrennungen und Augenschäden kommen. Das Einatmen seiner Dämpfe führt zu Reizungen der Atemwege. Beim Umgang mit HI sollte geeignete Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden. Es sollte an einem gut belüfteten Ort und fern von unverträglichen Substanzen gelagert werden. Bei versehentlichem Verschlucken oder Einatmen sofort einen Arzt aufsuchen. Bei Verschüttung mit geeigneten Mitteln neutralisieren und als Sondermüll entsorgen. Es ist wichtig, strenge Sicherheitsprotokolle zu befolgen und mit Vorsicht zu handhaben, um Unfälle und Verletzungen zu vermeiden.
| Gefahrensymbole | Ätzend |
| Sicherheitsbeschreibung | Verursacht schwere Hautverbrennungen und Augenschäden. Gesundheitsschädlich beim Einatmen. |
| UN-Identifikationsnummern | UN1787 |
| HS-Code | 28111990 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig |
Methoden zur Synthese von Jodwasserstoffsäure
Jodwasserstoff (HI) kann mit verschiedenen Methoden synthetisiert werden. Ein gängiger Ansatz beinhaltet die direkte Reaktion von Jod (I2) mit rotem Phosphor (P). Bei dieser Methode wird I2 mit rotem Phosphor vermischt, der als Reduktionsmittel wirkt. Die Reaktion findet in Gegenwart von Wasser statt und ergibt HI und Phosphorsäure.
Eine andere Methode beinhaltet die Reaktion von Jod mit Hydrazinhydrat (N2H4·H2O). Dieser Prozess erfordert aufgrund der potenziell gefährlichen Natur von Hydrazinhydrat eine sorgfältige Handhabung. Die Reaktion führt zur Bildung von HI und Stickstoffgas.
Alternativ kann auch die Reaktion von Jod mit konzentrierter Schwefelsäure (H2SO4) HI erzeugen. Bei dieser Methode wird Jod mit konzentrierter Schwefelsäure vermischt, wodurch HI-Gas entsteht, das gesammelt und in flüssiger Form kondensiert werden kann.
Es ist unbedingt zu beachten, dass die Synthese von Jodwasserstoff unter entsprechenden Sicherheitsvorkehrungen durchgeführt werden muss. Die beteiligten Chemikalien können gefährlich sein und bei den Reaktionen können giftige Gase entstehen. Eine ordnungsgemäße Belüftung, Schutzausrüstung und die Einhaltung von Sicherheitsvorkehrungen sind während des Syntheseprozesses von entscheidender Bedeutung, um eine sichere und erfolgreiche Produktion von Jodwasserstoff zu gewährleisten.
Verwendung von Jodwasserstoffsäure
Aufgrund seiner einzigartigen Eigenschaften findet Jodwasserstoff (HI) vielfältige Anwendungen in verschiedenen Branchen. Hier sind einige wichtige Verwendungszwecke:
- Organische Synthese: In der organischen Chemie wird HI als wesentlicher Reaktant zur Umwandlung von Alkylhalogeniden in Alkane verwendet, ein Prozess, der als Dehalogenierung bekannt ist.
- Pharmazeutische Industrie: Die Herstellung verschiedener pharmazeutischer Verbindungen, einschließlich jodhaltiger Arzneimittel und jodhaltiger Kontrastmittel für die medizinische Bildgebung, bezogen auf HI.
- Reduktionsmittel: HI wirkt aktiv als starkes Reduktionsmittel bei chemischen Reaktionen und unterstützt die Reduktion von Metallionen in ihre elementare Form.
- Katalyse: HI beteiligt sich aktiv als Katalysator an bestimmten chemischen Reaktionen, erhöht die Reaktionsgeschwindigkeit und verbessert die Ausbeute spezifischer Umwandlungen.
- Reinigen und Ätzen: Die Elektronik- und Halbleiterindustrie nutzt HI aufgrund seiner Fähigkeit, Metalle und Metalloxide aufzulösen, aktiv für Reinigungs- und Ätzprozesse.
- Analytische Chemie: Iodometrische Titrationen in der analytischen Chemie nutzen HI aktiv, um die Konzentration bestimmter Substanzen anhand ihrer Reaktion mit Jod zu bestimmen.
- Metalloberflächenbehandlung: HI spielt aktiv eine Rolle bei der Vorbereitung von Metalloberflächen für das Plattieren, Hartlöten und andere Oberflächenbehandlungsprozesse.
- Jodidherstellung: Verschiedene Branchen nutzen HI aktiv zur Herstellung von Jodidverbindungen für verschiedene Anwendungen in Bereichen wie Fotografie, Medizin und organische Synthese.
- Laborreagenz: Labore nutzen HI aktiv als nützliches Reagenz für viele chemische Reaktionen und Experimente.
Die vielseitigen Eigenschaften von Jodwasserstoff machen es zu einem wertvollen Werkzeug in der chemischen Forschung, in industriellen Prozessen und in der pharmazeutischen Entwicklung und tragen zu Fortschritten in zahlreichen Sektoren und wissenschaftlichen Entdeckungen bei.
Fragen:
F: Welche Verbindung könnte der Jodwasserstoffsäure (HI) zugesetzt werden, um ihre sauren Eigenschaften zu neutralisieren?
A: Eine Base wie Natriumhydroxid (NaOH) kann hinzugefügt werden, um den Jodwasserstoff zu neutralisieren und Wasser und ein Salz zu bilden.
F: Ist Jodwasserstoffsäure eine starke Säure?
A: Ja, Jodwasserstoff ist eine starke Säure, was bedeutet, dass er in Wasser vollständig ionisiert und dabei Wasserstoffionen freisetzt.
F: Wie lautet die Formel für Jodwasserstoffsäure?
A: Die Formel für Jodwasserstoff lautet HI und steht für ein Wasserstoffatom, das an ein Jodatom gebunden ist.
F: Wie lautet die Formel für Jodwasserstoffsäure?
A: Die Formel für Jodwasserstoff ist HI.
F: Wie viele Milliliter 0,550 M Jodwasserstoffsäure werden benötigt, um mit 10,00 ml 0,217 M CsOH zu reagieren?
A: Ungefähr 17,58 ml 0,550 M Jodwasserstoff werden benötigt, um mit 10,00 ml 0,217 M CsOH zu reagieren.
F: Ist Jodwasserstoffsäure illegal?
A: Jodwasserstoff selbst ist nicht illegal, aber seine Verwendung und sein Besitz können aufgrund seiner potenziellen Gefahren und seiner Verwendung bei illegalen Aktivitäten reguliert werden.
F: Was bilden Jodwasserstoff und Magnesiumsulfid?
A: Jodwasserstoff und Magnesiumsulfid reagieren unter Bildung von Schwefelwasserstoffgas (H2S) und Magnesiumjodidsalz (MgI2).
F: Was passiert, wenn man Jodwasserstoff mit Backpulver mischt?
A: Wenn Jodwasserstoff mit Backpulver (Natriumbikarbonat) reagiert, entstehen Kohlendioxid, Wasser und Natriumjodid.
F: Wie wirkt Jodwasserstoff in Wasser?
A: Jodwasserstoff ionisiert in Wasser und setzt Wasserstoffionen (H+) und Jodidionen (I-) frei, was zu einer sehr sauren Lösung führt.
F: Nettoionengleichung von Natriumhydroxid und Jodwasserstoff?
A: Die Nettoionengleichung für die Reaktion zwischen Natriumhydroxid (NaOH) und Jodwasserstoff (HI) lautet Na+ + OH- + H+ + I- → Na+ + I- + H2O.
