Jod (I2) ist ein Molekül, das aus zwei Jodatomen besteht. Bei Raumtemperatur ist es ein dunkel gefärbter Feststoff und kann beim Erhitzen zu einem violetten Dampf sublimieren. Jod ist ein wesentliches Element für die Produktion von Schilddrüsenhormonen beim Menschen.
| IUPAC-Name | Dijod |
| Molekularformel | I2 |
| CAS-Nummer | 7553-56-2 |
| Synonyme | Molekulares Jod, molekulares Jod, Jodkristalle, sublimiertes Jod, zweiatomiges Jod |
| InChI | InChI=1S/I2/c1-2 |
Eigenschaften von Jod
Jodformel
Die chemische Formel für Jod lautet I2, was darauf hinweist, dass es aus zwei Jodatomen besteht. Die Formel wird unter Verwendung der Elementsymbole und Indizes geschrieben, um die Anzahl der vorhandenen Atome anzugeben. Die Jodformel ist wichtig für die Bestimmung der chemischen Eigenschaften von Jod und für die Beschreibung chemischer Reaktionen, an denen Jod beteiligt ist.
Molmasse von Jod
Die Molmasse von I2 beträgt etwa 253,81 g/mol. Es ist ein Halogenelement, das zur gleichen Gruppe wie Fluor, Chlor, Brom und Astat gehört. Die Molmasse von I2 wird durch Addition der Atommassen seiner beiden Atome berechnet, die jeweils 126,90 g/mol betragen. Die Molmasse von I2 spielt eine entscheidende Rolle bei der Bestimmung der Menge an I2, die in einer bestimmten Probe vorhanden ist.
Siedepunkt von Jod
Der Siedepunkt von I2 liegt bei 184,3 °C, was es bei Raumtemperatur zu einem Feststoff macht. Beim Erhitzen sublimiert I2 direkt in ein violettes Gas, ohne eine flüssige Phase zu durchlaufen. Der Siedepunkt von I2 ist im Vergleich zu anderen Halogenen wie Chlor und Brom relativ niedrig. Dieser niedrige Siedepunkt ermöglicht eine einfache Reinigung von I2 durch Sublimation.
Schmelzpunkt von Jod
I2 hat einen Schmelzpunkt von 113,7 °C, was im Vergleich zu anderen Halogenen relativ niedrig ist. Dieser niedrige Schmelzpunkt bedeutet, dass I2 leicht geschmolzen und für verschiedene Anwendungen verwendet werden kann, beispielsweise für die Fotografie und die Herstellung von I2-Kristallen. Darüber hinaus liegt der Schmelzpunkt von I2 nahe an seinem Siedepunkt, was die Reinigung durch Sublimation erleichtert.
Joddichte g/ml
Die Dichte von I2 beträgt bei Raumtemperatur und -druck etwa 4,93 g/ml. Das bedeutet, dass I2 dichter ist als Wasser, das eine Dichte von 1 g/ml hat. Die hohe Dichte von I2 macht es für verschiedene Anwendungen nützlich, beispielsweise für die Herstellung organischer Verbindungen und als Kontrastmittel in der medizinischen Bildgebung.
Molekulargewicht von Jod
Das Molekulargewicht von I2 wird durch Addition der Atomgewichte seiner beiden Atome berechnet. Das Atomgewicht von I2 beträgt 126,90 g/mol, was bedeutet, dass sein Molekulargewicht etwa 253,81 g/mol beträgt. Das Molekulargewicht von I2 ist ein wichtiger Faktor bei der Bestimmung seiner physikalischen und chemischen Eigenschaften.
Struktur von Jod
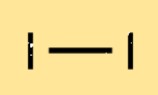
I2 ist ein zweiatomiges Molekül, das heißt, es besteht aus zwei I-Atomen. Diese Atome werden durch eine kovalente Bindung zusammengehalten, die entsteht, wenn die Atome Elektronen teilen. Die Bindung zwischen den beiden Atomen ist relativ schwach, weshalb I2 im Vergleich zu anderen Halogenen einen niedrigen Schmelz- und Siedepunkt hat.
| Aussehen | Dunkelgrau-schwarzer kristalliner Feststoff |
| Spezifisches Gewicht | 4,93 g/cm³ |
| Farbe | Violett (Dampf), dunkelgraues Schwarz (fest) |
| Geruch | Scharf, erstickend |
| Molmasse | 253,81 g/Mol |
| Dichte | 4,93 g/cm³ |
| Fusionspunkt | 113,7°C |
| Siedepunkt | 184,3°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 0,03 g/100 ml bei 20 °C |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie Ethanol, Ether und Chloroform |
| Dampfdruck | 0,4 mmHg bei 25°C |
| Wasserdampfdichte | 8,7 (Luft = 1) |
| pKa | 10.3 |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Jod
I2 kann bei unsachgemäßer Handhabung gefährlich sein. Es kann schwere Reizungen und Verbrennungen an Haut und Augen verursachen und bei Einnahme großer Mengen giftig sein. Auch das Einatmen von I2-Dämpfen kann Atemprobleme verursachen. I2 sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von Hitze und Zündquellen, gelagert werden. Beim Umgang mit I2 sollte geeignete persönliche Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske getragen werden. Bei Exposition sollten die betroffenen Bereiche mit Wasser gespült und sofort ein Arzt aufgesucht werden. Es ist wichtig, beim Umgang mit I2 die richtigen Sicherheitsprotokolle zu befolgen, um mögliche Gefahren zu vermeiden.
| Gefahrensymbole | T (giftig), Xn (gesundheitsschädlich) |
| Sicherheitsbeschreibung | Von Hitze/Funken/offener Flamme/heißen Oberflächen fernhalten. Staub/Rauch/Gas/Nebel/Dampf/Aerosol nicht einatmen. Handschuhe/Kleidung/Augenschutz/Gesichtsschutz tragen. BEI EINATMEN: Das Opfer an die frische Luft bringen und in einer Position ruhigstellen, die das Atmen erleichtert. BEI VERSCHLUCKEN: Mund ausspülen. KEIN Erbrechen herbeiführen. BEI BERÜHRUNG MIT DER HAUT (oder dem Haar): Alle kontaminierten Kleidungsstücke sofort ausziehen. Haut mit Wasser abspülen/duschen. |
| UN-Identifikationsnummern | UN 3490 (Jod), UN 3491 (Festes Jod) |
| HS-Code | 2801.20 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | II |
| Toxizität | Jod kann bei Einnahme großer Mengen giftig sein und schwere Reizungen und Verätzungen der Haut und Augen verursachen. Auch das Einatmen von Joddampf kann Atembeschwerden verursachen. |
Methoden zur Synthese von Jod
Verschiedene Methoden können I2 synthetisieren.
Eine gängige Methode ist die Oxidation von Jodidionen mit Oxidationsmitteln wie Chlor oder Salpetersäure . Die Sandmeyer-Reaktion ist der Name dieser Methode.
Eine andere Methode beinhaltet die Reaktion von ICl mit Kaliumiodid . Die Merck-Reaktion ist der Name dieser Methode.
I2 kann auch aus Algen gewonnen werden, die eine natürliche Quelle für I2 darstellen. Der Prozess umfasst das Ernten und Verbrennen von Algen, um I2 aus der Asche zu extrahieren. Die Calvert-Lewin-Reaktion ist der Name dieser Methode.
Durch die Reaktion zwischen Jodwasserstoff und Wasserstoffperoxid kann I2 synthetisiert werden. Der Dowd-Prozess ist der Name dieser Methode.
Eine andere Methode beinhaltet die Reaktion von Jodid und Phosphor, wodurch Phosphortriiodid und roter Phosphor entstehen. Phosphortriiodid wird hydrolysiert, um I2 zu produzieren.
Es gibt mehrere andere Methoden zur Synthese von I2, darunter die Reaktion von Iodid mit Kaliumhydroxid, die Reaktion von Iodid und Schwefelsäure und die Elektrolyse von Iodidlösungen. Die Wahl der Methode hängt von der konkreten Anwendung und der Verfügbarkeit der Rohstoffe ab.
Verwendung von Jod
I2 hat ein breites Einsatzspektrum in verschiedenen Branchen und Anwendungen. Hier sind einige der häufigsten Anwendungen von I2:
- Medizin: Wird in der Medizin als Antiseptikum, Desinfektionsmittel und Sterilisationsmittel verwendet. Es behandelt auch Schilddrüsenerkrankungen wie Kropf und Hyperthyreose.
- Fotografie: Um ein lichtempfindliches Material für die Fotografie herzustellen, verwenden Hersteller I2 bei der Herstellung von Silberiodid.
- Landwirtschaft: Wird als Bodennährstoff zur Förderung des Pflanzenwachstums und zur Vorbeugung von Jodmangel bei Nutztieren verwendet.
- Lebensmittelindustrie: Um Jodmangel vorzubeugen, fügen Menschen Salz und anderen Lebensmitteln I2 als Nahrungsergänzungsmittel hinzu.
- Wasseraufbereitung: Wird als Wasserdesinfektionsmittel und zur Entfernung von Verunreinigungen aus dem Wasser verwendet.
- Chemische Industrie: Wird bei der Herstellung verschiedener Chemikalien wie Polymere, Farbstoffe und Pharmazeutika verwendet.
- Analytische Chemie: Wird als Reagenz in der analytischen Chemie zum Nachweis des Vorhandenseins von Stärke, Lipiden und anderen Verbindungen verwendet.
- Kernenergie: Nuklearmedizin und Krebsbehandlung nutzen I-131.
- Wissenschaftliche Forschung: Wird auch in der wissenschaftlichen Forschung zur Untersuchung verschiedener chemischer und biologischer Prozesse verwendet.
Fragen:
F: Ist Jod ein Metall?
A: Nein, I2 ist kein Metall. Es ist ein Nichtmetall.
F: Wie viele Valenzelektronen hat Jod?
A: Jod hat 7 Valenzelektronen.
F: Was ist Jod?
A: I2 ist ein chemisches Element mit dem Symbol I und der Ordnungszahl 53. Es ist ein Nichtmetall, das für die menschliche Gesundheit unerlässlich ist und verschiedene industrielle und wissenschaftliche Anwendungen hat.
F: Wofür wird Jod verwendet?
A: I2 hat ein breites Anwendungsspektrum, unter anderem als Antiseptikum, Desinfektionsmittel, Nahrungsergänzungsmittel, Wasseraufbereitungsmittel, Bodennährstoff und bei der Herstellung verschiedener Chemikalien, Pharmazeutika und Polymere.
F: Ist I2 polar oder unpolar?
A: I2 (Jod) ist ein unpolares Molekül.
F: Wie hoch ist die durchschnittliche Trainingsrate von i2?
A: Die durchschnittliche Geschwindigkeit der I2-Bildung hängt von der spezifischen Reaktion und den beteiligten Bedingungen ab und sollte experimentell oder durch theoretische Analyse berechnet werden.
F: Was ist I2?
A: I2 ist die chemische Formel für Jod, ein nichtmetallisches Element, das Teil der Halogengruppe des Periodensystems ist. Es ist bei Raumtemperatur ein dunkelvioletter Feststoff und ein Halogen mit einer Vielzahl industrieller und medizinischer Anwendungen.
