Isopropanol (Isopropylalkohol), auch Reinigungsalkohol genannt, ist eine farblose, brennbare chemische Verbindung. Aufgrund seiner starken und wirksamen Eigenschaften wird es häufig als Lösungsmittel, Desinfektionsmittel und Antiseptikum verwendet.
| IUPAC-Name | Propan-2-ol |
| Molekularformel | C3H8O |
| CAS-Nummer | 67-63-0 |
| Synonyme | Isopropylalkohol, 2-Propanol, trockener Propylalkohol, Dimethylcarbinol, IPA, Reinigungsalkohol |
| InChI | InChI=1S/C3H8O/c1-3(2)4/h3-4H,1-2H3 |
Eigenschaften von Isopropanol
Struktur von Isopropylalkohol
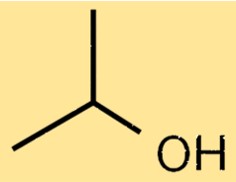
Die Struktur von Isopropylalkohol besteht aus einer Propankette mit einer Hydroxylgruppe (-OH), die an das zentrale Kohlenstoffatom gebunden ist. Die Hydroxylgruppe verleiht Isopropylalkohol seine charakteristischen Eigenschaften als Alkohol, einschließlich seiner Fähigkeit, sich in Wasser zu lösen und als Lösungsmittel für viele organische Verbindungen zu fungieren. Das Vorhandensein einer Methylgruppe (-CH3) am ersten Kohlenstoffatom der Propankette verleiht Isopropylalkohol seine einzigartigen Eigenschaften, einschließlich seiner relativ niedrigen Siede- und Schmelzpunkte.
Isopropylalkohol Molmasse
Die Molmasse von Isopropylalkohol, auch Reinigungsalkohol genannt, beträgt 60,1 g/mol. Die Molmasse ist die Masse eines Mols einer Substanz. Sie entspricht der Menge einer Substanz, die genauso viele Einheiten enthält, wie 12 Gramm Kohlenstoff-12 Atome enthalten. Im Fall von Isopropylalkohol enthält ein Mol Substanz 60,1 Gramm. Die Molmasse ist ein wichtiger Parameter in vielen chemischen Berechnungen, insbesondere zur Bestimmung der Menge einer Substanz, die für eine Reaktion benötigt wird, oder der Konzentration einer Lösung.
Isopropylalkohol. Siedepunkt
Der Siedepunkt von Isopropylalkohol beträgt 82,6 °C (180,7 °F) bei Atmosphärendruck. Der Siedepunkt ist die Temperatur, bei der ein Stoff von einer Flüssigkeit in einen Gaszustand übergeht, und es handelt sich um eine physikalische Eigenschaft, die durch die zwischenmolekularen Kräfte des Stoffes bestimmt wird. Isopropylalkohol hat im Vergleich zu anderen Alkoholen wie Ethanol aufgrund seiner geringen Größe und des Vorhandenseins einer Methylgruppe einen relativ niedrigen Siedepunkt.
Isopropylalkohol. Schmelzpunkt
Der Schmelzpunkt von Isopropylalkohol liegt bei -89 °C (-128,2 °F). Der Schmelzpunkt ist die Temperatur, bei der ein Stoff vom Feststoff in den flüssigen Zustand übergeht, und ist außerdem eine physikalische Eigenschaft, die durch die zwischenmolekularen Kräfte des Stoffes bestimmt wird. Isopropylalkohol hat im Vergleich zu anderen Alkoholen aufgrund seiner geringen Größe und des Vorhandenseins einer Methylgruppe einen relativ niedrigen Schmelzpunkt.
Isopropylalkohol Dichte g/ml
Die Dichte von Isopropylalkohol beträgt 0,786 g/ml bei Raumtemperatur (20 °C oder 68 °F). Die Dichte ist die Masse einer Substanz pro Volumeneinheit und eine physikalische Eigenschaft, die durch die atomare und molekulare Struktur der Substanz bestimmt wird. Isopropylalkohol hat eine geringere Dichte als Wasser, das bei Raumtemperatur eine Dichte von 1 g/ml hat.
Molekulargewicht von Isopropylalkohol
Das Molekulargewicht von Isopropylalkohol beträgt 60,1 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome eines Moleküls und eine charakteristische Eigenschaft der Substanz. Isopropylalkohol hat ein relativ niedriges Molekulargewicht im Vergleich zu anderen Alkoholen, wie beispielsweise Ethanol, das ein Molekulargewicht von 46,1 g/mol hat.
Isopropylalkohol-Formel
Die chemische Formel für Isopropylalkohol lautet C3H8O. Diese Formel stellt die Anzahl und Art der Atome dar, aus denen das Isopropylalkoholmolekül besteht. Die Formel zeigt, dass Isopropylalkohol drei Kohlenstoffatome, acht Wasserstoffatome und ein Sauerstoffatom enthält. Diese Formel ist nützlich bei der Bestimmung des Molekulargewichts und anderer physikalischer und chemischer Eigenschaften von Isopropylalkohol.
| Aussehen | Klare, farblose Flüssigkeit |
| Spezifisches Gewicht | 0,786 g/ml bei 20 °C |
| Farbe | Farblos |
| Geruch | Charakteristisch, alkoholisch |
| Molmasse | 60,1 g/Mol |
| Dichte | 0,786 g/ml bei 20 °C |
| Fusionspunkt | -89 °C (-128,2 °F) |
| Siedepunkt | 82,6 °C (180,7 °F) bei Atmosphärendruck |
| Blitzpunkt | 12,2 °C (54 °F) |
| Löslichkeit in Wasser | Völlig mischbar |
| Löslichkeit | Mischbar mit organischen Lösungsmitteln |
| Dampfdruck | 33,8 mmHg bei 20°C |
| Wasserdampfdichte | 2,07 (Luft = 1) |
| pKa | 16.5 |
| pH-Wert | 7 (neutral) |
Sicherheit und Gefahren von Isopropanol
Isopropanol ist eine leicht entzündliche und flüchtige Flüssigkeit mit niedrigem Flammpunkt und sollte mit Vorsicht gehandhabt werden. Es kann zu Reizungen der Haut und der Augen führen und eine längere oder wiederholte Einwirkung kann zu Trockenheit und Rissbildung der Haut führen. Isopropanol kann beim Einatmen auch Reizungen der Atemwege und Schwindel verursachen, und die Einnahme kann zu Übelkeit, Erbrechen und Bauchschmerzen führen. Bei der Arbeit mit Isopropanol ist es wichtig, geeignete Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske zu tragen. Die Lagerung sollte an einem kühlen, trockenen und gut belüfteten Ort erfolgen, entfernt von Wärmequellen und inkompatiblen Materialien.
| Gefahrensymbole | F, Xi |
| Sicherheitsbeschreibung | Leicht entzündliche Flüssigkeit und Dampf. Verursacht schwere Augenreizung. Verursacht Hautreizungen. Gesundheitsschädlich beim Verschlucken. Kann vermutlich genetische Anomalien verursachen. Kann vermutlich die Fruchtbarkeit beeinträchtigen oder das ungeborene Kind beeinträchtigen. Kann Schläfrigkeit oder Schwindelgefühl verursachen. |
| AN-Kennungen | UN1219 |
| HS-Code | 2905.12.0000 |
| Gefahrenklasse | 3 |
| Verpackungsgruppe | II |
| Toxizität | LD50 (oral, Ratte): 5.630 mg/kg |
Methoden zur Synthese von Isopropanol
Isopropanol, auch Isopropylalkohol genannt, kann auf verschiedene Weise synthetisiert werden.
Eine übliche Methode besteht darin, Propylen mithilfe eines Katalysators wie Schwefelsäure oder Phosphorsäure zu hydratisieren. Der Prozess beinhaltet die Reaktion von Propylen mit Wasser in Gegenwart des Katalysators, wobei als Nebenprodukt Isopropanol und Diisopropylether entstehen.
Eine andere Methode beinhaltet die Hydrierung von Aceton unter Verwendung eines Katalysators wie Kupferchromit oder Nickel. Der Prozess nutzt Wasserstoffgas und den Katalysator, um Aceton zu Isopropanol zu reduzieren.
Einige Bakterienstämme können Isopropanol produzieren, indem sie Kohlenhydrate wie Mais oder Zuckerrohr fermentieren. Der Prozess umfasst die Umwandlung von Kohlenhydraten in Glukose, die dann von Bakterien zu Isopropanol fermentiert wird.
Eine andere Methode zur Synthese von Isopropanol beinhaltet die Reaktion eines Grignard-Reagens mit Formaldehyd , gefolgt von einer säurekatalysierten Hydrolyse. Dieses Verfahren eignet sich besonders zur Herstellung von Isopropanol mit einem hohen Reinheitsgrad.
Unabhängig von der verwendeten Methode muss das resultierende Isopropanol durch Destillation oder andere Methoden gereinigt werden, um alle Verunreinigungen zu entfernen und den gewünschten Reinheitsgrad zu erreichen.
Verwendung von Isopropanol
Isopropanol, auch bekannt als Isopropylalkohol, findet vielfältige Verwendungsmöglichkeiten in verschiedenen Branchen und Anwendungen. Einige der häufigsten Anwendungen von Isopropanol sind:
- Lösungsmittel: Ein wirksames Lösungsmittel für eine Vielzahl von Substanzen, darunter Öle, Harze und Gummis. Wird als Lösungsmittel bei der Herstellung von Beschichtungen, Tinten und Klebstoffen verwendet.
- Desinfektionsmittel: Wird als Desinfektionsmittel in Gesundheitseinrichtungen, Labors und anderen Einrichtungen verwendet. Es wirkt gegen viele Krankheitserreger, darunter Bakterien, Viren und Pilze.
- Antiseptikum: Wird als Antiseptikum in verschiedenen topischen Anwendungen verwendet, beispielsweise in Händedesinfektionsmitteln und Desinfektionstüchern. Wird auch zur Vorbereitung der Haut auf medizinische Eingriffe verwendet.
- Reinigungsmittel: Wird in verschiedenen Reinigungsanwendungen verwendet, beispielsweise zum Reinigen elektronischer Komponenten, optischer Linsen und Präzisionsinstrumente.
- Kraftstoff: Wird als Kraftstoffzusatz in Benzin- und Dieselmotoren verwendet. Es wird auch in einigen Rennwagen als Treibstoff verwendet.
- Extraktionsmittel: Wird als Extraktionsmittel bei der Herstellung ätherischer Öle, Aromen und Parfüme verwendet.
- Chemisches Zwischenprodukt: Wird als chemisches Zwischenprodukt bei der Herstellung verschiedener Chemikalien wie Aceton, Isopropylacetat und Glycerin verwendet.
Fragen:
F: Ist Isopropylalkohol polar?
A: Ja, Isopropylalkohol ist ein polares Molekül. Es verfügt über eine Hydroxylgruppe (-OH), die an eine Kette aus drei Kohlenstoffatomen gebunden ist, was es zu einem polaren Molekül macht. Diese Polarität macht es zu einem guten Lösungsmittel für viele Substanzen.
F: Ist Isopropylalkohol dasselbe wie Reinigungsalkohol?
A: Reinigungsalkohol ist eine Art Alkohol, der aus Isopropylalkohol oder Ethanol hergestellt wird. Isopropylalkohol ist neben Wasser und anderen Verbindungen einer der Hauptbestandteile von Reinigungsalkohol. Obwohl Isopropylalkohol also nicht genau dasselbe ist wie Reinigungsalkohol, ist er ein wichtiger Bestandteil von Reinigungsalkohol.
F: Wo kann man Isopropylalkohol kaufen?
A: Isopropylalkohol kann aus verschiedenen Quellen gekauft werden, darunter Apotheken, Lebensmittelgeschäfte und Online-Händler. Es wird üblicherweise in Konzentrationen von 70 % bis 99 % verkauft, wobei 70 % am häufigsten vorkommt. Es ist wichtig zu beachten, dass Isopropylalkohol aufgrund der hohen Nachfrage und des Mangels in manchen Gegenden möglicherweise schwer zu finden ist.
