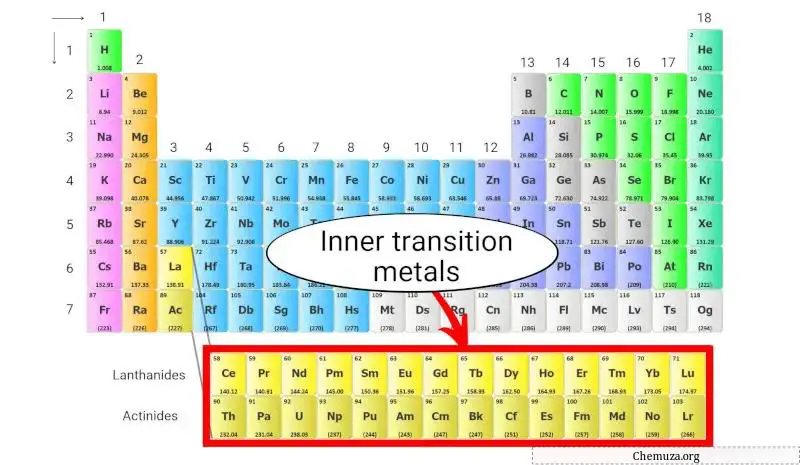
Die inneren Übergangsmetalle sind eine Gruppe chemischer Elemente, die sich in den unteren beiden Reihen des Periodensystems direkt unter dem Hauptübergangsmetallblock befinden.
Interne Übergangsmetalle werden in zwei Gruppen eingeteilt:
- Lanthanide , die Ordnungszahlen im Bereich von 57 bis 71 haben, und
- Actiniden mit Ordnungszahlen zwischen 89 und 103.
Lassen Sie uns mehr über die internen Übergangselemente des Periodensystems untersuchen.
Was sind interne Übergangsmetalle? Und warum sind sie unten platziert?
Die inneren Übergangsmetalle bilden die Gruppe der Elemente, die am Ende des Periodensystems stehen.
Diese inneren Übergangsmetalle sind nur ein Teil der Übergangsmetalle und haben auch ähnliche Eigenschaften wie Übergangsmetalle. Sie sind jedoch als Erweiterung der Gruppe 3 im Innenbereich platziert.
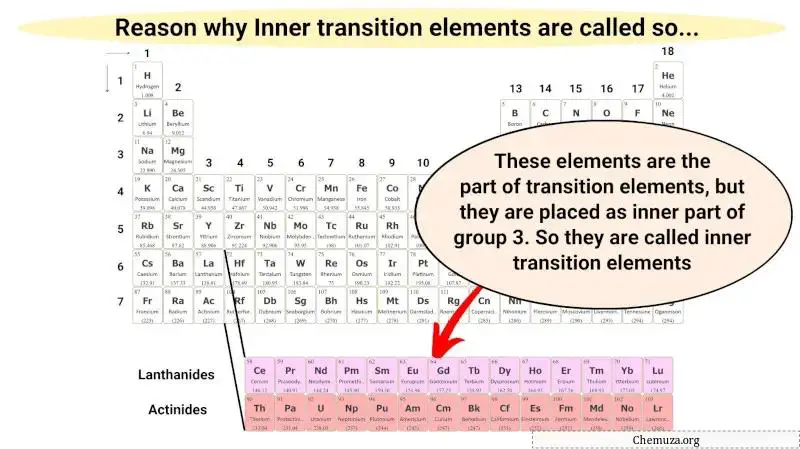
Daher werden diese metallischen Elemente interne Übergangsmetalle genannt.
Warum stehen sie am Ende des Periodensystems?
Wenn die inneren Übergangsmetalle als Erweiterung der Gruppe 3 platziert werden, erscheint das Periodensystem sehr lang (wie unten gezeigt).

Damit es auf Papier im A4-Format passt, werden die beiden Reihen der inneren Übergangsmetalle unten platziert.
Darüber hinaus haben diese internen Übergangselemente ihre Valenzelektronen im f-Orbital , wodurch diese Elemente ähnliche chemische Eigenschaften aufweisen.
Aus diesen Gründen stehen die inneren Übergangsmetalle am Ende des Periodensystems.
Liste der internen Übergangsmetalle
Die Liste der internen Übergangsmetalle ist unten aufgeführt.
| Ordnungszahl | Symbol | Elementname und Symbol |
| 57 | Dort | Lanthan |
| 58 | Das | Cer |
| 59 | Pr | Praseodym |
| 60 | sd | Neodym |
| 61 | PN | Promethium |
| 62 | Wenig | Samarium |
| 63 | UNS | Europium |
| 64 | Gott | Gadolinium |
| 65 | Tuberkulose | Terbium |
| 66 | Dy | Dysprosium |
| 67 | Ho | Holmium |
| 68 | Äh | Erbium |
| 69 | TM | Thulium |
| 70 | Yb | Ytterbium |
| 71 | Lesen | Lutetium |
| 89 | Ac | Aktinium |
| 90 | Th | Thorium |
| 91 | Pennsylvania | Protaktinium |
| 92 | U | Uran |
| 93 | Np | Neptunium |
| 94 | Könnte | Plutonium |
| 95 | Bin | Americium |
| 96 | cm | Curium |
| 97 | B.K. | Berkelium |
| 98 | Sehen | Kalifornien |
| 99 | Ist | Einsteinium |
| 100 | FM | Fermium |
| 101 | Maryland | Mendelevium |
| 102 | NEIN | Nobelium |
| 103 | L/R | Lawrence |
Fakten über interne Übergangsmetalle
Hier sind einige interessante Fakten über interne Übergangsmetalle:
- Es gibt zwei Arten interner Übergangsmetalle: Lanthanoide und Actinoide. Lanthaniden sind die 15 Elemente mit Ordnungszahlen im Bereich von 57 ( Lanthan ) bis 71 ( Lutetium ), während Aktiniden die 15 Elemente mit Ordnungszahlen im Bereich von 89 ( Aktinium ) bis 103 ( Lawrencium ) sind.
- Interne Übergangsmetalle weisen aufgrund des Vorhandenseins von f-Orbitalen einzigartige elektronische Konfigurationen auf. Dies führt zu ungewöhnlichen chemischen und physikalischen Eigenschaften wie hohen Schmelz- und Siedepunkten, Bildung komplexer Ionen und Paramagnetismus.
- Die meisten inneren Übergangsmetalle sind radioaktiv und einige wurden in Kernreaktoren und Waffen verwendet.
- Interne Übergangsmetalle sind in Technik und Industrie wichtig. Beispielsweise werden Neodym und Samarium zur Herstellung leistungsstarker Magnete [1] verwendet und Cer wird in Katalysatoren zur Reduzierung von Fahrzeugabgasen eingesetzt. [2]
- Lanthanoide werden auch „Seltene Erden“ genannt, da sie in der Erdkruste relativ selten vorkommen. Allerdings sind sie nicht wirklich selten und kommen in vielen Mineralien vor.
- Aktinide sind alle radioaktiv und einige, wie z. B. Uran und Plutonium , sind wichtig für Kernkraft und Waffen. Allerdings bergen sie aufgrund ihrer Radioaktivität auch Gefahren für die Umwelt und die Gesundheit.
- Innere Übergangsmetalle sind seit der Antike bekannt und wurden für Schmuck und Dekoration verwendet. Allerdings wurden sie erst im 20. Jahrhundert umfassend untersucht oder verstanden.
Eigenschaften interner Übergangsmetalle
Hier sind einige Eigenschaften interner Übergangsmetalle:
- Elektronische Konfiguration: Interne Übergangsmetalle haben teilweise gefüllte f-Orbitale, was ihnen einzigartige elektronische Konfigurationen und ungewöhnliche chemische und physikalische Eigenschaften verleiht.
- Hohe Schmelz- und Siedepunkte: Interne Übergangsmetalle haben aufgrund der starken metallischen Bindung, die aus der Anwesenheit ungepaarter Elektronen in den f-Orbitalen resultiert, hohe Schmelz- und Siedepunkte.
- Paramagnetismus: Interne Übergangsmetalle sind paramagnetisch, das heißt, sie werden aufgrund der Anwesenheit ungepaarter Elektronen in den f-Orbitalen von einem Magnetfeld angezogen.
- Bildung komplexer Ionen: Interne Übergangsmetalle können aufgrund der Verfügbarkeit leerer f-Orbitale, die Elektronen von anderen Atomen oder Molekülen aufnehmen können, komplexe Ionen bilden.
- Radioaktivität: Viele innere Übergangsmetalle sind aufgrund der Anwesenheit instabiler Isotope in ihren Kernen radioaktiv.
- Oxidationsstufen: Interne Übergangsmetalle weisen aufgrund der Verfügbarkeit mehrerer Valenzelektronen in f-Orbitalen eine Reihe von Oxidationsstufen auf, einschließlich hoher Oxidationsstufen.
- Ähnliche chemische Eigenschaften: Lanthaniden und Aktiniden haben ähnliche chemische Eigenschaften, sodass sie schwer voneinander zu trennen sind.
- Metallischer Glanz: Interne Übergangsmetalle sind im Allgemeinen glänzend und haben aufgrund ihres hohen Lichtreflexionsvermögens einen metallischen Glanz.
Verwendung interner Übergangsmetalle
Interne Übergangsmetalle haben aufgrund ihrer einzigartigen Eigenschaften ein breites Anwendungsspektrum. Einige der Verwendungszwecke interner Übergangsmetalle sind:
- Kernenergie: Viele interne Übergangsmetalle, insbesondere Aktinide wie Uran, werden als Brennstoff für Kernreaktoren und Waffen verwendet.
- Magnete: Lanthanide wie Neodym, Samarium und Gadolinium werden zur Herstellung leistungsstarker Magnete für eine Vielzahl von Anwendungen verwendet, darunter Computerfestplatten, Windkraftanlagen und MRT-Geräte.
- Beleuchtung: Lanthanide wie Europium und Terbium werden zur Herstellung von Leuchtstoffen für Leuchtstoff- und LED-Beleuchtung verwendet. [3]
- Katalyse: Lanthanide wie Cer werden als Katalysatoren in vielen industriellen Prozessen verwendet, einschließlich der Erdölraffinierung und der Kontrolle der Umweltverschmutzung.
- Glasherstellung: Lanthanide wie Erbium und Ytterbium werden zum Färben von Glas verwendet, während Cer zum Polieren von Glas verwendet wird.
- Medizinische Bildgebung: Lanthanide wie Gadolinium und Terbium werden in Kontrastmitteln für MRT-Untersuchungen verwendet. [4]
- Elektronik: Lanthanide wie Dysprosium und Terbium werden in elektronischen Geräten wie Mikrowellenfiltern und LCD-Bildschirmen verwendet.
- Verteidigung: Interne Übergangsmetalle werden in Verteidigungstechnologien verwendet, darunter Atomwaffen und panzerbrechende Munition.
Zusammenfassung
Die inneren Übergangsmetalle sind eine Gruppe chemischer Elemente, die sich in den unteren beiden Reihen des Periodensystems direkt unter dem Hauptübergangsmetallblock befinden.
Sie werden in zwei Gruppen eingeteilt: die Lanthaniden und die Aktiniden, deren Ordnungszahlen zwischen 57 und 71 bzw. 89 und 103 liegen.
Die internen Übergangsmetalle befinden sich am Ende des Periodensystems, da sich ihre Valenzelektronen im f-Orbital befinden, das ähnliche chemische Eigenschaften aufweist.
Interne Übergangsmetalle haben hohe Schmelz- und Siedepunkte, komplexe Ionenbildung und Paramagnetismus. Aufgrund der Verfügbarkeit mehrerer Valenzelektronen in den f-Orbitalen weisen sie auch eine Reihe von Oxidationsstufen auf, einschließlich hoher Oxidationsstufen.
