Ameisensäure oder HCOOH ist eine farblose Flüssigkeit mit stechendem Geruch. Es wird häufig als Konservierungsmittel und antibakterielles Mittel sowie bei der Herstellung von Leder, Textilien und Gummi verwendet.
| IUPAC-Name | Methansäure |
| Molekularformel | HCOOH |
| CAS-Nummer | 64-18-6 |
| Synonyme | Hydrogencarbonsäure, Formylsäure, Aminosäure, Formylsäure, Metacarbonsäure, Thionylameisensäure usw. |
| InChI | InChI=1S/CH2O2/c2-1-3/h1H,(H,2,3) |
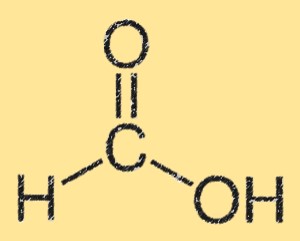
Struktur von Ameisensäure
Die Struktur der Ameisensäure ist durch eine Carbonsäuregruppe (-COOH) gekennzeichnet, die an ein einzelnes Kohlenstoffatom gebunden ist. Das Kohlenstoffatom ist außerdem an ein Wasserstoffatom und ein Sauerstoffatom gebunden. Die Struktur der Ameisensäure ist planar und weist Wasserstoffbrückenbindungen zwischen den Carbonsäuregruppen auf. Die Wasserstoffbindung führt zu seiner hohen Löslichkeit in Wasser.
Ameisensäureformel
Die chemische Formel für Ameisensäure lautet HCOOH. Es ist eine einfache organische Verbindung, die ein Kohlenstoffatom, ein Sauerstoffatom und zwei Wasserstoffatome enthält. Die Formel der Ameisensäure ist wichtig für die Bestimmung ihrer chemischen und physikalischen Eigenschaften sowie ihres Verhaltens unter verschiedenen Bedingungen. Es wird auch in verschiedenen chemischen Berechnungen verwendet, beispielsweise in der Stöchiometrie und Molarität.
Lewis-Struktur HCOOH
Die Lewis-Struktur von Ameisensäure (HCOOH) ist wie folgt:
H
|
C=O
|
OH
Im Zentrum der Struktur steht das Kohlenstoffatom mit vier Valenzelektronen. Es bildet Einfachbindungen mit den beiden Wasserstoffatomen und dem Sauerstoffatom, das über zwei freie Elektronenpaare verfügt. Das Sauerstoffatom bildet außerdem mit dem anderen Kohlenstoffatom eine Doppelbindung, die ein Paar freier Elektronen trägt. Die Lewis-Struktur zeigt, dass das Molekül aufgrund des Elektronegativitätsunterschieds zwischen den Kohlenstoff- und Sauerstoffatomen eine polare kovalente Bindung aufweist.
Ameisensäure Molmasse
Die Molmasse der Ameisensäure, auch Methansäure genannt, beträgt 46,03 g/mol. Seine chemische Formel lautet HCOOH, was bedeutet, dass es ein Kohlenstoffatom, ein Sauerstoffatom und zwei Wasserstoffatome enthält. Die Molmasse ist ein wichtiger Parameter zur Bestimmung der Menge einer Substanz, die zur Herstellung einer Lösung einer bestimmten Konzentration benötigt wird. Um beispielsweise eine 1 M Ameisensäurelösung herzustellen, müssten 46,03 g Ameisensäure in 1 Liter Lösungsmittel gelöst werden.
Siedepunkt von Ameisensäure
Der Siedepunkt von HCOOH beträgt 100,8 °C (213,4 °F). Es ist eine farblose Flüssigkeit mit stechendem Geruch und sehr gut wasserlöslich. Der Siedepunkt von HCOOH ist relativ niedrig, sodass es leicht verdampft und destilliert werden kann. Diese Eigenschaft macht es in verschiedenen industriellen Anwendungen nützlich, beispielsweise bei der Herstellung von Farbstoffen, Kunststoffen und Pharmazeutika.
HCOOH Schmelzpunkt
Der Schmelzpunkt von HCOOH beträgt 8,4 °C (47,1 °F). Es ist bei Raumtemperatur ein Feststoff und kann in seiner reinen Form durch Abkühlen unter seinen Schmelzpunkt gewonnen werden. HCOOH-Kristalle sind weiß und verströmen einen stechenden Geruch. Der Schmelzpunkt von HCOOH ist im Vergleich zu anderen Carbonsäuren relativ niedrig, was es zu einem nützlichen Lösungsmittel für bestimmte chemische Reaktionen macht.
HCOOH-Dichte g/ml
Die Dichte von HCOOH beträgt 1.220 g/ml bei 25 °C (77 °F). Es ist dichter als Wasser, das bei gleicher Temperatur eine Dichte von 1000 g/ml hat. Die Dichte von HCOOH ist eine wichtige Eigenschaft, die seine Löslichkeit in Wasser und anderen Lösungsmitteln bestimmt. Dies beeinflusst auch sein Verhalten unter verschiedenen Bedingungen wie Temperatur und Druck.
Molekulargewicht von Ameisensäure
Das Molekulargewicht von Ameisensäure beträgt 46,03 g/mol. Es ist eine einfache organische Verbindung mit der chemischen Formel HCOOH. Das Molekulargewicht ist ein wichtiger Parameter zur Bestimmung der physikalischen und chemischen Eigenschaften eines Stoffes. Es wird verwendet, um verschiedene Größen zu berechnen, beispielsweise die Anzahl der Mol, die Masse und das Volumen eines Stoffes.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 1.22 |
| Farbe | Farblos |
| Geruch | Acre |
| Molmasse | 46,03 g/Mol |
| Dichte | 1.220 g/ml |
| Fusionspunkt | 8,4°C |
| Siedepunkt | 100,8°C |
| Blitzpunkt | 68°C |
| Löslichkeit in Wasser | Mischbar |
| Löslichkeit | Löslich in den meisten organischen Lösungsmitteln |
| Dampfdruck | 44,5 mmHg |
| Wasserdampfdichte | 1,5 (Luft=1) |
| pKa | 3,75 |
| pH-Wert | 2.4 |
Sicherheit und Gefahren von Ameisensäure
HCOOH birgt mehrere Sicherheits- und Gefahrenrisiken. Es handelt sich um eine stark ätzende und giftige Substanz, die bei Kontakt schwere Hautverbrennungen und Augenschäden verursachen kann. Das Einatmen von HCOOH-Dämpfen kann zu Reizungen der Atemwege und Lungenschäden führen. Außerdem ist es brennbar und kann sich bei hohen Temperaturen entzünden, was eine Brandgefahr darstellt. Beim Umgang mit HCOOH sind entsprechende Sicherheitsvorkehrungen zu treffen, einschließlich der Verwendung von Schutzkleidung, Handschuhen und Augenschutz. Es sollte an einem kühlen, trockenen und gut belüfteten Ort gelagert werden, entfernt von inkompatiblen Materialien wie Oxidationsmitteln und Alkalien.
| Gefahrensymbole | Ätzend, giftig |
| Sicherheitsbeschreibung | Schutzhandschuhe und Augen-/Gesichtsschutz tragen. Bei Augenkontakt sofort mit reichlich Wasser spülen und einen Arzt aufsuchen. |
| UN-Identifikationsnummern | UN1779 |
| HS-Code | 2915.11.00 |
| Gefahrenklasse | 8 (ätzend) |
| Verpackungsgruppe | II (Mittelstufe) |
| Toxizität | LD50 1,8 g/kg (oral, Ratte) |
Methoden zur Synthese von Ameisensäure
Ameisensäure kann auf verschiedene Weise synthetisiert werden.
- Eine übliche Methode beinhaltet die Reaktion von Kohlenmonoxid und Wasser in Gegenwart eines Katalysators wie Rhodium oder Kobalt. Dies ist der Formox-Prozess. Bei diesem Prozess entstehen Ameisensäure und Wasserstoffgas.
- Eine andere Methode beinhaltet die Oxidation von Formaldehyd mit einem starken Oxidationsmittel wie Chromsäure oder Kaliumpermanganat unter sauren Bedingungen. Bei dieser Reaktion entstehen Ameisensäure und Wasser.
- Eine Möglichkeit zur Synthese von Ameisensäure besteht darin, Natriumformiat mit Schwefelsäure umzusetzen. Bei dieser Reaktion entstehen als Nebenprodukt Ameisensäure und Natriumsulfat.
- Ameisen produzieren als natürlichen Abwehrmechanismus Ameisensäure, die durch Destillation aus ihrem Körper gewonnen werden kann.
- Eine andere Methode zur Synthese von HCOOH beinhaltet die Reaktion von Kohlendioxid mit Wasserstoff in Gegenwart eines Katalysators wie Kupferchromit oder Zinkoxid. Bei diesem als HCOOH-Synthesereaktion bekannten Prozess entstehen HCOOH und Wasser.
- HCOOH kann auch aus natürlichen Quellen gewonnen werden, beispielsweise aus Brennnesselblättern, wo es in geringen Mengen vorkommt.
Insgesamt stehen für die Synthese von HCOOH mehrere Methoden zur Verfügung, von denen jede ihre Vor- und Nachteile hat.
Verwendung von Ameisensäure
Ameisensäure hat ein breites Anwendungsspektrum in verschiedenen Branchen.
- Aufgrund ihrer Fähigkeit, das Wachstum schädlicher Mikroorganismen zu verhindern, wird Ameisensäure häufig als Konservierungsmittel und antibakterielles Mittel in Tierfutter und Silage eingesetzt.
- Es hilft, das Wachstum schädlicher Mikroorganismen in Futtermitteln und Silage zu verhindern, was es zu einem nützlichen Zusatzstoff macht.
- Die Textilindustrie verwendet Ameisensäure als Färbe- und Ausrüstungsmittel für Stoffe, um die Farbechtheit zu verbessern und die Affinität von Farbstoffen zu Fasern zu erhöhen.
- Ameisensäure dient als Lösungsmittel und Zwischenprodukt bei der Herstellung verschiedener Chemikalien wie Essigsäure, Formamid und Methanol.
- Ameisensäure ist ein Gerbstoff, der in der Lederindustrie verwendet wird und dazu beiträgt, die Textur und Haltbarkeit von Lederprodukten zu verbessern.
- Bei der Gummiherstellung unterstützt Ameisensäure den Vulkanisationsprozess, indem sie als Gerinnungsmittel dient.
- Die Pharmaindustrie verwendet Ameisensäure als Konservierungsmittel für Impfstoffe und als Desinfektionsmittel für medizinische Geräte.
- Darüber hinaus findet Ameisensäure Anwendung bei der Herstellung verschiedener Arzneimittel, darunter Diuretika und Antihistaminika.
- Ameisensäure ist ein Reduktionsmittel bei organischen Synthesereaktionen und ein Katalysator bei Polymerisationsreaktionen.
- Ameisensäure trägt dazu bei, das Aroma verschiedener Produkte zu verbessern, wodurch sie bei der Herstellung von Geschmacks- und Duftstoffen nützlich ist.
Insgesamt ist die Vielfalt der Anwendungen von Ameisensäure in verschiedenen Branchen auf ihre einzigartigen Eigenschaften und ihre Vielseitigkeit zurückzuführen.
Fragen:
F. Ist Ameisensäure eine starke Säure?
A. Ameisensäure ist eine schwache Säure mit einem pKa-Wert von etwa 3,75. Das bedeutet, dass es in Wasser nicht vollständig dissoziiert und eine schwächere Säure ist als starke Säuren wie Salzsäure oder Schwefelsäure.
F. Was ist saurere Ameisen- oder Essigsäure?
A. Ameisensäure ist saurer als Essigsäure. Dies ist auf das Vorhandensein einer Methylgruppe in der Essigsäure zurückzuführen, die die negative Ladung der konjugierten Base stabilisiert und so die Wahrscheinlichkeit einer Dissoziation verringert. Andererseits hat Ameisensäure eine kleinere Molekülgröße und ein stärkeres elektronegatives Atom (Sauerstoff), was die Dissoziation erleichtert und sie saurer macht.
F. Welche Ameise produziert Ameisensäure?
A. Ameisensäure wird von mehreren Ameisenarten produziert, darunter Waldameisen, Feuerameisen und einige Arten stachelloser Bienen. Die Säure wird im Körper der Ameise gespeichert und dient als Abwehrmechanismus gegen Fressfeinde. Bei Bedrohung schießt die Ameise möglicherweise Ameisensäure aus ihrem Stachel oder setzt sie aus speziellen Drüsen in ihrem Körper frei.
