Ethylenglykol (C2H6O2) ist eine klare, geruchlose und süß schmeckende Flüssigkeit, die häufig in Frostschutzmitteln und anderen industriellen Anwendungen verwendet wird. Bei Einnahme ist es giftig und kann ernsthafte Gesundheitsprobleme verursachen.
| IUPAC-Name | Ethan-1,2-diol |
| Molekularformel | C2H6O2 |
| CAS-Nummer | 107-21-1 |
| Synonyme | 1,2-Ethandiol, Glykol, Monoethylenglykol, MEG, Ethylenalkohol, hypodikarbonische Säure, Ethylendihydrat |
| InChI | InChI=1S/C2H6O2/c3-1-2-4/h3-4H,1-2H2 |
Eigenschaften von Ethylenglykol
Molmasse von Ethylenglykol
Monoethylenglykol (MEG) hat eine Molmasse von 62,07 g/mol. Die Molmasse ist die Masse eines Mols einer Substanz, ausgedrückt in Gramm. Die Molmasse von Monoethylenglykol kann verwendet werden, um die Menge an Monoethylenglykol zu bestimmen, die in einer bestimmten Anwendung benötigt wird, beispielsweise als Frostschutzmittel für ein Fahrzeug.
Formel mit Ethylenglykol
Die chemische Formel für Ethylenglykol lautet C2H6O2. Die Formel gibt die Anzahl der Atome jedes Elements in einem Ethylenglykolmolekül an. Die Formel von Ethylenglykol ist wichtig für die Bestimmung seiner Eigenschaften, wie Siedepunkt, Schmelzpunkt und Dichte. Die Formel kann auch verwendet werden, um die Menge an Ethylenglykol zu berechnen, die für eine bestimmte Anwendung benötigt wird.
Siedepunkt von Ethylenglykol
Monoethylenglykol hat bei Atmosphärendruck einen Siedepunkt von 197,3 °C (387,1 °F). Der Siedepunkt ist die Temperatur, bei der ein Stoff vom flüssigen in den gasförmigen Zustand übergeht. Der hohe Siedepunkt von Monoethylenglykol macht es zu einem wirksamen Kühlmittel und Frostschutzmittel für den Einsatz in Automobilen und anderen Anwendungen.
Schmelzpunkt von Ethylenglykol
Monoethylenglykol hat einen Schmelzpunkt von -12,9 °C (8,8 °F). Der Schmelzpunkt ist die Temperatur, bei der ein Stoff vom festen in den flüssigen Zustand übergeht. Der niedrige Schmelzpunkt von Monoethylenglykol sorgt dafür, dass es bei niedrigen Temperaturen flüssig bleibt, was es zu einem wirksamen Kühlmittel für den Einsatz in kalten Klimazonen macht.
Dichte von Ethylenglykol g/ml
Die Dichte von Monoethylenglykol beträgt 1,11 g/ml bei 20 °C (68 °F). Die Dichte ist das Maß für die Massemenge, die in einem bestimmten Volumen enthalten ist. Die hohe Dichte von Monoethylenglykol macht es zu einem wirksamen Kühlmittel und Frostschutzmittel für den Einsatz in Automobilen und anderen Anwendungen mit begrenztem Platzangebot.
Molekulargewicht von Ethylenglykol
Das Molekulargewicht von Monoethylenglykol beträgt 62,07 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül. Das Molekulargewicht von Monoethylenglykol ist wichtig für die Bestimmung der Menge an Monoethylenglykol, die für eine bestimmte Anwendung benötigt wird, beispielsweise als Frostschutzmittel für ein Fahrzeug.
Struktur von Ethylenglykol
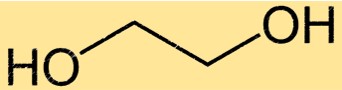
Monoethylenglykol hat eine einfache chemische Struktur, die aus zwei Hydroxylgruppen besteht, die an eine Kette mit zwei Kohlenstoffatomen gebunden sind. Die Summenformel von Monoethylenglykol lautet C2H6O2 und sein IUPAC-Name ist Ethan-1,2-diol. Die einfache Struktur von Monoethylenglykol macht es zu einem wirksamen Lösungsmittel und Frostschutzmittel für den Einsatz in einer Vielzahl von Anwendungen.
| Aussehen | Klare, geruchlose Flüssigkeit |
| Spezifisches Gewicht | 1,113 bei 20°C |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 62,07 g/Mol |
| Dichte | 1,11 g/cm³ |
| Fusionspunkt | -12,9 °C (8,8 °F) |
| Siedepunkt | 197,3 °C (387,1 °F) |
| Blitzpunkt | 111°C (232°F) |
| Löslichkeit in Wasser | Mischbar |
| Löslichkeit | Löslich in Aceton, Alkoholen, Benzol und Ether |
| Dampfdruck | 0,08 mmHg bei 25°C |
| Wasserdampfdichte | 2,14 (Luft = 1) |
| pKa | 14,0 (erster), 13,2 (zweiter) |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Ethylenglykol
Obwohl Monoethylenglykol viele praktische Anwendungen hat, birgt es auch mehrere Risiken für die menschliche Gesundheit und die Umwelt. Monoethylenglykol ist bei Einnahme hochgiftig und kann schwere Gesundheitsprobleme bis hin zu Nierenversagen und sogar zum Tod verursachen. Das Einatmen von Monoethylenglykoldämpfen kann zu Reizungen der Atemwege und des Zentralnervensystems führen. Monoethylenglykol ist außerdem brennbar und kann mit bestimmten Chemikalien heftig reagieren. Es muss daher sorgfältig gehandhabt und ordnungsgemäß gelagert werden. Darüber hinaus ist Monoethylenglykol schädlich für Wasserlebewesen und sollte nicht in Gewässer oder die Umwelt gelangen. Beim Umgang mit Monoethylenglykol müssen entsprechende Sicherheitsmaßnahmen getroffen werden, um Unfälle zu vermeiden und die Gesundheit von Mensch und Umwelt zu schützen.
| Gefahrensymbole | Totenkopf mit gekreuzten Knochen, ätzend |
| Sicherheitsbeschreibung | Nicht einnehmen. Kontakt mit Haut und Augen vermeiden. Bei ausreichender Belüftung verwenden. Tragen Sie Schutzhandschuhe und Schutzbrille. |
| UN-Identifikationsnummern | UN 3082 |
| HS-Code | 2905.32.00 |
| Gefahrenklasse | 6.1 (giftig) |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig beim Verschlucken. Kann Nierenversagen und andere schwerwiegende Gesundheitsprobleme verursachen. Das Einatmen von Dämpfen kann zu Reizungen der Atemwege und Auswirkungen auf das Zentralnervensystem führen. |
Methoden zur Synthese von Ethylenglykol
Es gibt verschiedene Methoden zur Synthese von Monoethylenglykol, einem Schlüsselelement in vielen industriellen Prozessen.
Eine übliche Methode ist die katalytische Hydratisierung von Ethylenoxid , bei der Ethylenoxid mit Wasser in Gegenwart eines Katalysators wie einer starken Säure oder eines Metalloxids umgesetzt wird.
Eine andere Methode ist die Hydrolyse von Ethylencarbonat, das durch die Reaktion von Ethylenoxid mit Kohlendioxid entsteht.
Eine andere Möglichkeit, Monoethylenglykol zu synthetisieren, ist die Oxidation von Ethylen. Der Prozess verwendet einen Silberoxidkatalysator, um Ethylen zu oxidieren und Ethylenoxid zu erzeugen, das dann einer Hydrolyse unterzogen wird, um Monoethylenglykol zu produzieren.
Zur Synthese von Monoethylenglykol kann Oxalsäure mit Wasserstoff reduziert werden, wodurch Glykolsäure entsteht. Anschließend entsteht durch Dehydratisierung von Glykolsäure Monoethylenglykol.
Verwendung von Ethylenglykol
Monoethylenglykol findet dank seiner einzigartigen Eigenschaften und Vielseitigkeit viele industrielle und kommerzielle Anwendungen. Zu seinen Hauptanwendungen gehören:
- Frostschutzmittel: Wird als Kühlmittel und Frostschutzmittel in Automobil- und Industrieanwendungen verwendet. Sein niedriger Gefrierpunkt und sein hoher Siedepunkt machen es zur idealen Wahl, um Motorschäden durch Einfrieren oder Überhitzen zu verhindern.
- Enteisungsmittel: Wird aufgrund seiner Fähigkeit, den Gefrierpunkt von Wasser zu senken, als Enteisungsmittel für Flugzeuge, Straßen und Gehwege verwendet.
- Lösungsmittel: Ein sehr wirksames Lösungsmittel für eine Vielzahl von Substanzen, darunter Harze, Öle und Farbstoffe. Hersteller verwenden es häufig bei der Herstellung von Farben, Beschichtungen und Klebstoffen.
- Feuchthaltemittel: Wird in der Kosmetik- und Körperpflegeindustrie als Feuchthaltemittel verwendet, um Feuchtigkeitsverlust in Produkten wie Lotionen und Shampoos zu verhindern.
- Chemisches Zwischenprodukt: Wird als wichtiges Zwischenprodukt bei der Herstellung einer breiten Palette von Chemikalien verwendet, darunter Polyesterfasern und -folien, Polyurethane und Weichmacher.
- Wärmeübertragungsflüssigkeit: Wird als Wärmeübertragungsflüssigkeit in verschiedenen industriellen Anwendungen verwendet, einschließlich HVAC-Systemen, Solarkollektoren und Geothermiesystemen.
Fragen:
F: Was ist Ethylenglykol?
A: Monoethylenglykol ist eine klare, farblose, geruchlose und süß schmeckende Flüssigkeit, die üblicherweise als Kühlmittel und Frostschutzmittel in Automobil- und Industrieanwendungen verwendet wird. Es wird auch als Lösungsmittel, Feuchthaltemittel und chemisches Zwischenprodukt in verschiedenen Industrien verwendet.
F: Wie hoch ist der Dampfdruck von Ethylenglykol bei seinem normalen Siedepunkt?
A: Der Dampfdruck von Monoethylenglykol bei seinem normalen Siedepunkt von 197,3 °C (387,1 °F) beträgt 0,00131 atm.
F: Ist Ethylenglykol polar?
A: Ja, Monoethylenglykol ist ein polares Molekül, da zwei funktionelle Gruppen -OH vorhanden sind, die ein Dipolmoment erzeugen und es ihm ermöglichen, sich in polaren Lösungsmitteln aufzulösen.
F: Wie misst man den pH-Wert von Ethylenglykol?
A: Der pH-Wert von Monoethylenglykol kann mit einem pH-Meter oder pH-Indikatorstreifen gemessen werden, die speziell für die Verwendung mit nichtwässrigen Lösungsmitteln entwickelt wurden. Es ist wichtig zu beachten, dass Monoethylenglykol kein neutraler Stoff ist, sondern eine schwache Säure mit einem pH-Wert von etwa 6,5.
F: Wie wirkt sich Ethylenglykol auf den Körper aus?
A: Monoethylenglykol kann bei Einnahme oder Absorption über die Haut giftig sein, da es von der Leber zu giftigen Nebenprodukten verstoffwechselt wird, die Nierenversagen, Krampfanfälle und sogar den Tod verursachen können. Zu den Symptomen einer Monoethylenglykolvergiftung gehören Kopfschmerzen, Schwindel, Übelkeit, Erbrechen und Verwirrtheit.
F: Welche Formel stellt 1,2-Ethandiol dar?
A: Die Formel für 1,2-Ethandiol, auch bekannt als Monoethylenglykol, lautet C2H6O2.
F: Was sind Newmans Prognosen für 1,2-Ethandiol?
A: Newman-Projektionen für 1,2-Ethandiol zeigen zwei verschobene Konformationen, wobei die -OH-Gruppen in einer verdeckten oder versetzten Position relativ zueinander ausgerichtet sind.
