Ethylen, auch Ethylen genannt, ist ein farbloses, brennbares Gas mit süßem Geruch. Es ist ein wesentlicher Bestandteil der chemischen Industrie und wird bei der Herstellung von Kunststoffen, Lösungsmitteln und anderen Chemikalien verwendet.
| Name der IUPAC | Ethen |
| Molekularformel | C2H4 |
| CAS-Nummer | 74-85-1 |
| Synonyme | Ethylen, Ethen (fälschlicherweise), ölbildendes Gas, Elayl, 1,2-Dihydrogenethylen |
| InChI | InChI=1S/C2H4/c1-2/h1-2H2 |
Ethylenformel
Die chemische Formel für Ethen lautet C2H4. Es gibt die Anzahl und Art der in einem Ethenmolekül vorhandenen Atome an. Die Formel wird bei chemischen Reaktionen und Berechnungen mit Ethylen verwendet, beispielsweise zur Bestimmung der Stöchiometrie einer Reaktion oder der Menge an Ethylen, die für einen bestimmten industriellen Prozess erforderlich ist.
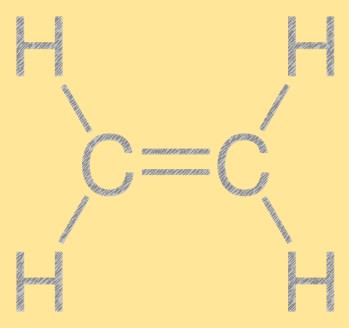
Ethylenstruktur
Ethylen hat eine einfache lineare Struktur mit zwei Kohlenstoffatomen, die durch eine Doppelbindung verbunden sind, und vier Wasserstoffatomen, die an jedes Kohlenstoffatom gebunden sind. Die Kohlenstoff-Kohlenstoff-Doppelbindung ist für die Reaktivität von Ethylen verantwortlich und macht es zu einem nützlichen Baustein in der chemischen Industrie. Das Molekül hat eine planare Struktur, wobei alle Atome in derselben Ebene liegen.
Ethen-Molmasse
Die Molmasse von Ethen, auch Ethylen genannt, beträgt 28,05 g/mol. Es ist ein einfaches organisches Molekül, das aus zwei Kohlenstoffatomen und vier Wasserstoffatomen besteht und durch die chemische Formel C2H4 dargestellt wird. Die Molmasse wird durch Addition der Atommassen der einzelnen Atome im Molekül berechnet.
Die Molmasse ist ein wichtiger Parameter bei chemischen Reaktionen und Berechnungen mit Ethylen. Es wird verwendet, um die Menge an Ethylen zu bestimmen, die in einer Reaktion benötigt wird, sowie die Menge an Produkten, die produziert werden können.
Siedepunkt von Ethylen
Der Siedepunkt von Ethen liegt bei -103,7 °C (-154,7 °F). Ethylen ist bei Raumtemperatur und -druck ein Gas und sein Siedepunkt ist viel niedriger als der von Wasser, wodurch es in industriellen Prozessen leichter von anderen Stoffen abgetrennt werden kann.
Der Siedepunkt von Ethen hängt vom Druck und der Reinheit der Probe ab. Bei höheren Drücken steigt der Siedepunkt von Ethen. Ebenso können in der Probe vorhandene Verunreinigungen dazu führen, dass der Siedepunkt vom erwarteten Wert abweicht.
Schmelzpunkt von Ethen
Der Schmelzpunkt von Ethylen beträgt -169,2 °C (-272,6 °F). Ethylen ist ein unpolares Molekül mit linearer Form, was es im Vergleich zu vielen anderen organischen Verbindungen zu einem relativ einfachen Molekül macht. Dies spiegelt sich in seinem niedrigen Schmelzpunkt wider.
Ebenso wie der Siedepunkt kann auch der Schmelzpunkt von Ethylen je nach Reinheit der Probe variieren. Verunreinigungen können den Schmelzpunkt senken und die Gewinnung einer reinen Probe für Versuchszwecke erschweren.
Ethylendichte g/ml
Die Dichte von Ethylen beträgt 0,958 g/ml unter Standardtemperatur- und -druckbedingungen (STP), definiert als 0 °C (32 °F) und 1 atm Druck. Ethylen hat eine geringere Dichte als Luft und kann daher aufsteigen und sich in der Atmosphäre verteilen.
Die Dichte ist eine wichtige physikalische Eigenschaft von Ethylen, da sie in industriellen Prozessen verwendet wird, um die Menge an Ethylen zu bestimmen, die für ein bestimmtes Raumvolumen benötigt wird. Es wird auch zur Berechnung der Ethylenmasse in einer Probe verwendet.
Molekulargewicht von Ethylen
Das Molekulargewicht von Ethylen beträgt 28,05 g/mol. Es ist die Summe der Atomgewichte der Atome, aus denen das Molekül besteht. Das Molekulargewicht ist ein wichtiger Parameter in vielen chemischen Berechnungen, insbesondere bei der Bestimmung der Stöchiometrie einer Reaktion und der Menge der benötigten oder produzierten Reaktanten und Produkte.
| Aussehen | Farbloses Gas |
| Spezifische Dichte | 0,968 g/ml bei 20 °C (68 °F) |
| Farbe | Farblos |
| Geruch | Süß, würzig |
| Molmasse | 28,05 g/Mol |
| Dichte | 0,958 g/ml bei 0 °C und 1 atm |
| Fusionspunkt | -169,2°C (-272,6°F) |
| Siedepunkt | -103,7 °C (-154,7 °F) bei 1 atm Druck |
| Blitzpunkt | -136°C (-213°F) |
| Löslichkeit in Wasser | 3,5 g/L bei 25 °C (77 °F) |
| Löslichkeit | Unlöslich in Wasser, löslich in organischen Lösungsmitteln |
| Dampfdruck | 114,6 kPa bei 20 °C (68 °F) |
| Wasserdampfdichte | 0,97 (Luft = 1) |
| pKa | 44 |
| pH-Wert | Nicht zutreffend, da Ethylen keine wässrige Lösung ist |
Sicherheit und Gefahren von Ethylen
Ethylen ist ein leicht entzündliches Gas, das mit Luft explosive Gemische bilden kann. Bei ausreichend hoher Konzentration kann es sich an der Luft spontan entzünden. Ethylen wirkt zudem erstickend und kann in geschlossenen Räumen Sauerstoff verdrängen, was eine Schockgefahr darstellt.
Der Kontakt mit flüssigem Ethylen oder die Einwirkung hoher Gaskonzentrationen kann zu Erfrierungen oder Verbrennungen führen. Ethylen ist nicht giftig, seine Verbrennungsprodukte, darunter Kohlenmonoxid und Kohlendioxid, können jedoch gesundheitsschädlich sein.
Der Umgang mit Ethylen erfordert geeignete Sicherheitsmaßnahmen, einschließlich ausreichender Belüftung, persönlicher Schutzausrüstung und Brandschutzvorkehrungen. Ethylen sollte in gut belüfteten Bereichen, entfernt von Zündquellen, gelagert und transportiert werden.
| Gefahrensymbole | Entzündbares Gas (GHS02), einfaches Erstickungsmittel (GHS09) |
| Sicherheitsbeschreibung | Von Zündquellen fernhalten – Nicht rauchen. Verwenden Sie nur funkenfreie Werkzeuge. Atmen Sie kein Gas ein. Nur im Freien oder in einem gut belüfteten Bereich verwenden. Schutzhandschuhe/Schutzkleidung/Augenschutz/Gesichtsschutz tragen. |
| UN-Identifikationsnummern | UN 1962 (Druckgas) |
| HS-Code | 2901.21.00 |
| Gefahrenklasse | 2.1 (brennbares Gas) |
| Verpackungsgruppe | N / A |
| Toxizität | Ungiftig |
Methoden der Ethylensynthese
Zur Synthese von Ethylen können verschiedene Methoden eingesetzt werden, darunter das thermische Cracken von Kohlenwasserstoffen und die Dehydratisierung von Alkoholen.
Beim thermischen Cracken werden Kohlenwasserstoffe wie Methan, Propan und Naphtha in Gegenwart eines Katalysators auf hohe Temperaturen (500 bis 900 °C) erhitzt, um langkettige Moleküle in kleinere Moleküle aufzuspalten und so Ethylen zu erzeugen. Produkte.
Eine weitere gängige Methode ist die Alkoholdehydratisierung, bei der ein Katalysator wie Aluminiumoxid oder Siliciumdioxid bei hohen Temperaturen (250–350 °C) verwendet wird, um Ethanol oder andere Alkohole zu dehydrieren und Ethylen und Wasser zu bilden.
Dampfcracken ist ein weiteres Verfahren zur Herstellung von Ethylen, bei dem Kohlenwasserstoffen bei hohen Temperaturen (700–900 °C) Wasserdampf zugesetzt wird, um eine Mischung aus Ethylen und anderen Produkten zu erzeugen.
Auch die thermische Zersetzung organischer Materialien wie Holz, Papier und Kunststoffe kann zur Bildung von Ethylen führen.
Weitere Methoden zur Synthese von Ethylen sind die oxidative Dehydrierung von Ethan und die Umwandlung von Methanol in Olefine.
Verwendung von Ethylen
Ethylen ist eine wichtige Industriechemikalie mit vielfältigen Einsatzmöglichkeiten.
- Ethylen spielt eine entscheidende Rolle bei der Herstellung von Polyethylen, einem der am häufigsten verwendeten Kunststoffe weltweit. Menschen verwenden Polyethylen in verschiedenen Anwendungen wie Verpackungen, Rohren und Baumaterialien.
- Hersteller verwenden Ethylen als Hauptbestandteil bei der Herstellung anderer Polymere wie Polyvinylchlorid (PVC). PVC wird in Baumaterialien, medizinischen Geräten und Elektrokabeln eingesetzt.
- Ethylen ist auch bei der Herstellung von Ethylenoxid von entscheidender Bedeutung, einem wesentlichen Rohstoff für die Herstellung von Waschmitteln, Lösungsmitteln und Kunststoffen.
- Hersteller verwenden Ethylen zur Herstellung von Ethylenglykol, einem Kühlmittel und Frostschutzmittel für Motoren. Es ist auch ein Rohstoff für die Herstellung von Polyesterfasern, -folien und -harzen.
- Ethylen wird als Brennstoff zum Schweißen und Schneiden von Metallen verwendet. Es dient auch als Reifungsmittel für Obst und Gemüse.
- Ethylen ist bei der Synthese verschiedener organischer Verbindungen nützlich, darunter Ethanol und Acetaldehyd.
Insgesamt ist Ethylen aufgrund seiner Vielseitigkeit ein wesentlicher Bestandteil in einer Vielzahl industrieller Prozesse und trägt zu vielen Aspekten des modernen Lebens bei.
Fragen:
Welche Diene reagieren mit Ethylen in einer Diels-Alder-Reaktion?
Jedes Dien, das zwei konjugierte Doppelbindungen enthält, kann mit Ethen eine Diels-Alder-Reaktion eingehen. Beispiele für solche Diene sind 1,3-Butadien und Isopren.
Wie sind Wasserstoffatome in Ethen angeordnet?
Im Ethen sind die beiden Kohlenstoffatome durch eine Doppelbindung miteinander verbunden. Jedes Kohlenstoffatom ist außerdem an zwei Wasserstoffatome gebunden, wobei die verbleibenden Valenzen von zwei ungeteilten Elektronenpaaren an jedem Kohlenstoffatom besetzt sind. Die Anordnung der Atome um jeden Kohlenstoff ist trigonal.
Wie viele Pi-Bindungen bilden sich, wenn die sp2-Hybridisierung in Ethen, C2H4, stattfindet?
Bei der sp2-Hybridisierung in Ethen wird eine Pi-Bindung zwischen den beiden Kohlenstoffatomen gebildet. Die sp2-Hybridorbitale sind an der Bildung von Sigma-Bindungen zwischen Kohlenstoffatomen und Wasserstoffatomen beteiligt, während sich die p-Orbitale jedes Kohlenstoffatoms überlappen, um die Pi-Bindung zu bilden. Ethylen wird als ungesättigter Kohlenwasserstoff klassifiziert, da es eine Doppelbindung zwischen seinen beiden Kohlenstoffatomen aufweist. Diese Doppelbindung besteht aus einer Sigma-Bindung und einer Pi-Bindung, was bedeutet, dass Ethen weniger Wasserstoffatome hat als ein vergleichbarer gesättigter Kohlenwasserstoff mit der gleichen Anzahl an Kohlenstoffatomen.
