Eisen-III-Nitrat ist eine chemische Verbindung. Es entsteht durch die Kombination von Eisenionen mit Nitrationen. Es wird häufig in industriellen Anwendungen und als Laborreagenz verwendet.
| IUPAC-Name | Eisen(III)-nitrat |
| Molekularformel | Fe(NO3)3 |
| CAS-Nummer | 10421-48-4 |
| Synonyme | Eisennitrat, Eisentrinitrat, Eisen(III)salz der Salpetersäure |
| InChI | InChI=1S/Fe.3NO3/c;3 2-1(3)4/q+3;3 -1 |
Eigenschaften von Eisen(III)-nitrat
Eisen(III)-nitrat-Formel
Die Formel für Eisen-III-Nitrat lautet Fe(NO3)3. Es besteht aus einem Eisenion (Fe) und drei Nitrationen (NO3). Diese Formel stellt die Kombination des Eisenkations mit den Nitrat-Anionen dar.
Molmasse von Eisen(III)-nitrat
Die Molmasse von Eisennitrat kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Eisen (Fe) hat eine Molmasse von 55,845 g/mol, während jedes Nitration (NO3) eine Molmasse von 62,0049 g/mol hat. Addiert man diese Werte, ergibt sich für Eisennitrat eine Molmasse von ca. 241,86 g/mol.
Siedepunkt von Eisen(III)-nitrat
Eisennitrat hat keinen bestimmten Siedepunkt. Beim Erhitzen zerfällt es in verschiedene Stickoxide und bildet schließlich Eisenoxid. Die Zersetzungstemperatur hängt von Faktoren wie der Konzentration und dem Vorhandensein anderer Stoffe ab.
Schmelzpunkt von Eisen(III)-nitrat
Der Schmelzpunkt von Eisennitrat liegt bei etwa 47 °C (117 °F). Bei dieser Temperatur geht die feste Verbindung in den flüssigen Zustand über. Es ist wichtig zu beachten, dass der Schmelzpunkt je nach Faktoren wie Verunreinigungen oder der genauen Zusammensetzung der Verbindung leicht variieren kann.
Dichte von Eisen(III)-nitraten g/ml
Die Dichte von Fe(NO3)3 beträgt etwa 1,68 g/ml. Die Dichte gibt die Masse pro Volumeneinheit eines Stoffes an. In diesem Fall gibt es die Masse an Fe(NO3)3 pro Milliliter der Verbindung an.
Molekulargewicht von Eisen(III)-nitrat
Das Molekulargewicht von Eisennitrat beträgt etwa 241,86 g/mol. Unter Molekulargewicht versteht man die Summe der Atomgewichte aller Atome in einem Molekül.
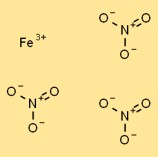
Struktur von Eisen(III)-nitrat
Eisennitrat hat in fester Form eine kristalline Struktur. Es besteht aus Fe3+-Kationen, umgeben von koordinierten Nitrat-Anionen (NO3-). Die Eisenkationen werden durch ionische Bindungen zusammengehalten, während die Nitratanionen durch elektrostatische Kräfte von den Kationen angezogen werden.
Löslichkeit von Eisen(III)-nitraten
Eisennitrat ist in Wasser sehr gut löslich. Es löst sich leicht in Wasser und bildet eine klare, hellgelbe Lösung. Die Löslichkeit von Eisennitrat in anderen Lösungsmitteln oder Stoffen kann variieren.
| Aussehen | Blassgelbe Kristalle |
| Spezifisches Gewicht | 1,68 |
| Farbe | Blassgelb |
| Geruch | Geruchlos |
| Molmasse | 241,86 g/Mol |
| Dichte | 1,68 g/ml |
| Fusionspunkt | 47°C (117°F) |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Wasser und polaren Lösungsmitteln |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Säure |
Sicherheit und Gefahren von Eisen(III)-nitrat
Eisennitrat birgt einige Sicherheitsrisiken und beim Umgang damit ist Vorsicht geboten. Es gilt als reizend für Haut, Augen und Atemwege. Direkter Kontakt mit der Verbindung sollte vermieden werden und Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden. Die Einnahme oder Inhalation von Eisennitrat kann schädliche Auswirkungen haben und sollte daher nicht eingenommen oder inhaliert werden. Es ist wichtig, mit dieser Verbindung in einem gut belüfteten Bereich zu arbeiten, um das Risiko einer Inhalation zu minimieren. Im Falle einer versehentlichen Exposition oder Einnahme sollte sofort ein Arzt aufgesucht werden. Um die Sicherheit zu gewährleisten, müssen ordnungsgemäße Lagerungs- und Handhabungspraktiken befolgt werden.
| Gefahrensymbole | Xi,O |
| Sicherheitsbeschreibung | Verursacht Haut- und Augenreizungen. Kann Reizungen der Atemwege verursachen. Gesundheitsschädlich beim Verschlucken. |
| UN-Identifikationsnummern | UN 1466 (wasserfrei) |
| HS-Code | 28342990 |
| Gefahrenklasse | 5.1 (Oxidationsmittel) |
| Verpackungsgruppe | II |
| Toxizität | Mäßige Toxizität |
Methoden zur Synthese von Eisen(III)-nitrat
Eisennitrat kann auf verschiedene Weise synthetisiert werden. Die übliche Methode besteht darin, Eisen(III)-oxid (Fe2O3) in konzentrierter Salpetersäure (HNO3) aufzulösen. Diese Reaktion führt zur Bildung von Eisennitrat, dargestellt durch die Gleichung:
Konzentrierte Salpetersäure löst Eisen(III)-oxid auf und erzeugt dabei Fe(NO3)3 sowie Wasser:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O.
Bei einer anderen Methode wird metallisches Eisen mit einer Mischung aus Salpetersäure und Wasserstoffperoxid kombiniert, wodurch das Eisen zu Eisennitrat oxidiert wird. Diese bekannte Reaktion verdient den Namen „Königswasser“-Methode.
Die Zugabe von metallischem Eisen zu einer Mischung aus Salpetersäure und Wasserstoffperoxid führt zur Bildung von Eisennitrat und Wasser:
2Fe + 8HNO3 + 6H2O2 → 2Fe(NO3)3 + 6H2O.
Aufgrund der korrosiven und oxidierenden Natur der beteiligten Chemikalien ist bei der Durchführung dieser Reaktionen äußerste Vorsicht geboten. Es ist notwendig, angemessene Sicherheitsmaßnahmen zu befolgen, wie z. B. das Tragen von Schutzausrüstung und das Arbeiten in einem gut belüfteten Bereich.
Seriöse Chemielieferanten bieten kommerziell erhältliches Eisennitrat an und stellen so eine konsistente und zuverlässige Quelle der Verbindung für verschiedene Anwendungen in Industrie und Laboratorien sicher.
Verwendung von Eisen(III)-nitrat
Eisennitrat hat in verschiedenen Industrien und Labors zahlreiche praktische Anwendungen. Hier sind einige wichtige Anwendungen von Eisennitrat:
- Industrieller Katalysator: Mehrere industrielle Prozesse, darunter die Herstellung von Nylon und anderen Polymeren, verwenden Eisennitrat als Katalysator.
- Färben und Pigmente: Die Färbe- und Pigmentindustrie verwendet Eisennitrat als Beizmittel, um Farbstoffe auf Stoffen zu fixieren und die Farbechtheit zu verbessern.
- Ätzmittel: Die Metallverarbeitungs- und Elektronikindustrie verwendet Eisennitrat als Ätzmittel, um komplizierte Muster und Designs auf Metalloberflächen zu erzeugen.
- Laborreagenz: Eisennitrat dient als gängiges Laborreagenz für verschiedene chemische Reaktionen und Experimente, insbesondere für die Synthese anderer Verbindungen.
- Oxidationsmittel: Eisennitrat wirkt aufgrund seiner starken oxidierenden Eigenschaften als Oxidationsmittel bei chemischen Reaktionen, einschließlich der organischen Synthese.
- Wasseraufbereitung: Eisennitrat ist in Wasseraufbereitungsprozessen nützlich, um Verunreinigungen wie Phosphate und Sulfide aus Industrieabwässern zu entfernen.
- Fotografie: Einige fotografische Prozesse, insbesondere die Herstellung eisenbasierter Fotoemulsionen, verwenden Eisennitrat.
- Analytische Chemie: Eisennitrat findet Anwendung in Techniken der analytischen Chemie, wie etwa der kolorimetrischen Analyse, um bestimmte Substanzen nachzuweisen und zu quantifizieren.
- Holzschutz: Holzschutzbehandlungen verwenden Eisennitrat als Wirkstoff, um das Holz vor Pilzfäule und Insektenbefall zu schützen.
- Pharmazeutische Anwendungen: Bei der Formulierung bestimmter pharmazeutischer Produkte und Medikamente wird Eisennitrat verwendet.
Es ist wichtig zu beachten, dass bei der Arbeit mit Eisennitrat aufgrund seiner ätzenden und oxidierenden Natur die richtige Handhabung und Sicherheitsvorkehrungen beachtet werden sollten.
Fragen:
F: Ist Eisen(III)-nitrat brennbar?
A: Nein, Eisennitrat ist nicht brennbar.
F: Welche Sicherheits- und Handhabungsbedenken gibt es bei Eisen(III)-nitrat?
A: Zu den Sicherheitsbedenken zählen Reizungen der Haut, Augen und Atemwege. Es muss daher mit geeigneter Schutzausrüstung und Vorsichtsmaßnahmen gehandhabt werden.
F: Welche Formel stellt Eisen(III)-nitrat dar?
A: Die Formel für Eisennitrat lautet Fe(NO3)3.
F: Wie lautet die Formel für Eisen(III)-nitrat?
A: Die Formel für Eisen(III)-nitrat lautet Fe(NO3)3.
F: Wie groß ist die Molmasse von Eisen(III)-nitrat?
A: Die Molmasse von Fe(NO3)3 beträgt etwa 241,86 g/mol.
F: Ist Eisenhydroxid wasserlöslich?
A: Eisenhydroxid ist in Wasser schlecht löslich.
F: Reagiert es mit Eisen(III)-nitrat?
A: Nein, Calcium (Ca) reagiert im Allgemeinen nicht mit Fe(NO3)3.
F: Mit welchem Teil von Aspirin reagiert Eisen(III)-nitrat?
A: Eisen(III)-nitrat reagiert mit der im Aspirinmolekül vorhandenen Carboxylatgruppe (-COO-).
F: Wie groß ist die Molekülmasse von Eisen(III)-nitrat?
A: Die Molekülmasse von Fe(NO3)3 beträgt etwa 241,86 g/mol.
F: Reagiert Al mit Eisen(III)-nitrat?
A: Ja, Aluminium (Al) kann mit Fe(NO3)3 unter Bildung von Aluminiumnitrat und metallischem Eisen reagieren.
F: Wie viele Mol Nitrat sind in 50,0 g Wasser in einer 3,80 M Eisen(III)-nitratlösung gelöst?
A: Um die Molmenge Nitrat zu bestimmen, ist das Volumen der Lösung erforderlich, da nur die Molarität und Masse des Wassers angegeben werden.
