Eisen(III)-hydroxid ist eine Verbindung, die durch die Reaktion von Eisen mit Wasser entsteht. Es wird häufig in Arzneimitteln, bei der Wasseraufbereitung und als Pigment in Farben verwendet.
| IUPAC-Name | Eisen(III)-hydroxid |
| Molekularformel | Fe(OH)₃ |
| CAS-Nummer | 20344-49-4 |
| Synonyme | Eisenhydroxid, Eisentrihydroxid, Eisenhydrat, Eisen(III)-oxyhydroxid |
| InChI | InChI=1S/Fe.3H2O/h;3*1H2/q+3;;;/p-3 |
Eigenschaften von Eisen(III)-hydroxid
Eisen(III)-hydroxid-Formel
Die Formel für Eisen(III)-hydroxid lautet Fe(OH)₃. Dies weist darauf hin, dass jedes Fe(OH)₃-Molekül aus einem Fe-Atom besteht, das an drei OH-Ionen gebunden ist.
Molmasse von Eisen(III)-hydroxid
Die Molmasse von Fe(OH)₃ kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Eisen hat eine Molmasse von 55,845 g/mol und jedes Hydroxid (OH)-Ion hat eine Molmasse von 17,007 g/mol. Daher beträgt die Molmasse von Fe(OH)₃ etwa 106,867 g/mol.
Siedepunkt von Eisen(III)-hydroxid
Fe(OH)₃ hat keinen genau definierten Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Stattdessen zersetzt es sich beim Erhitzen thermisch zu Eisen(III)-oxid und Wasser.
Schmelzpunkt von Eisen(III)-hydroxid
Auch Fe(OH)₃ zersetzt sich beim Erhitzen und hat keinen eindeutigen Schmelzpunkt. Bei hohen Temperaturen wandelt es sich in Eisen(III)-oxid und Wasser um.
Dichte von Eisen(III)-hydroxid g/ml
Die Dichte von Fe(OH)₃ hängt von verschiedenen Faktoren wie seinem Aggregatzustand (fest oder gelöst) und seiner Konzentration ab. Die Dichte einer festen Form von Fe(OH)₃ beträgt etwa 3,4 g/ml.
Molekulargewicht von Eisen(III)-hydroxid
Das Molekulargewicht von Fe(OH)₃ wird durch Addition der Atomgewichte seiner Atombestandteile berechnet. Das Molekulargewicht von Fe(OH)₃ beträgt etwa 106,867 g/mol.
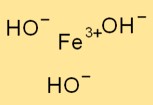
Struktur von Eisen(III)-hydroxid
Fe(OH)₃ nimmt eine trigonale Struktur an, bei der ein Eisenatom von drei Hydroxidionen umgeben ist. Als Zentralatom fungiert das Eisenatom, an das die Hydroxidionen über Ionenbindungen gebunden sind.
Löslichkeit von Eisen(III)-hydroxid
Fe(OH)₃ ist in Wasser nur begrenzt löslich. Beim Auflösen in Wasser bildet es einen Niederschlag und seine Löslichkeit hängt von verschiedenen Faktoren wie Temperatur, pH-Wert und der Anwesenheit anderer Ionen ab. Die Löslichkeit von Fe(OH)₃ nimmt unter sauren Bedingungen zu.
| Aussehen | Solides Braun |
| Spezifisches Gewicht | 3.4 |
| Farbe | Braun |
| Geruch | Geruchlos |
| Molmasse | 106.867 g/Mol |
| Dichte | 3,4 g/ml |
| Fusionspunkt | Zersetzt |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Unlöslich |
| Löslichkeit | Unlöslich. Hängt von Faktoren wie Temperatur, pH-Wert und der Anwesenheit anderer Ionen ab |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Ungefähr 5-7 |
Sicherheit und Gefahren von Eisen(III)-hydroxid
Fe(OH)₃ wirft bestimmte Sicherheitsbedenken und Gefahren auf. Es gilt allgemein als wenig toxisch. Allerdings kann das Verschlucken oder Einatmen großer Mengen zu Magen-Darm-Reizungen und Atembeschwerden führen. Es ist wichtig, den Kontakt mit Augen und Haut zu vermeiden, da dies zu Reizungen führen kann. Bei Kontakt die betroffenen Stellen mit reichlich Wasser abspülen. Beim Umgang mit Fe(OH)₃ empfiehlt es sich, geeignete Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen, um das Risiko einer Exposition zu minimieren. Um Staubansammlungen zu vermeiden, muss für eine ausreichende Belüftung gesorgt werden. Darüber hinaus ist es wichtig, Sicherheitsvorkehrungen zu befolgen und Fe(OH)₃ mit Vorsicht zu handhaben, um potenzielle Risiken zu minimieren.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | – Kontakt mit Augen und Haut vermeiden <br> – Schutzausrüstung tragen <br> – Für ausreichende Belüftung sorgen |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 2821.10.0000 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität |
Methoden zur Synthese von Eisen(III)-hydroxid
Es gibt verschiedene Methoden zur Synthese von Fe(OH)₃. Eine häufig verwendete Methode beinhaltet die Fällungsreaktion zwischen einem Eisensalz und einer Base. Beispielsweise kann durch Zugabe einer Eisenchloridlösung (FeCl₃) zu einer Natriumhydroxidlösung (NaOH) Fe(OH)₃ gebildet werden. Die Reaktion läuft wie folgt ab:
FeCl₃ + 3NaOH → Fe(OH)₃ + 3NaCl
Bei einer anderen Methode kann Eisen(II)-hydroxid zu Fe(OH)₃ oxidiert werden, indem man es der Luft aussetzt oder es mit einem Oxidationsmittel behandelt. Die Reaktion läuft wie folgt ab:
4Fe(OH)₂ + O₂ → 2Fe(OH)₃
Darüber hinaus kann Fe(OH)₃ durch Hydrolyse einer Eisensalzlösung hergestellt werden. Bei diesem Verfahren wird der Eisensalzlösung Wasser zugesetzt, was zur Bildung eines Niederschlags von Fe(OH)₃ führt. Die Reaktion läuft wie folgt ab:
FeCl₃ + 3H₂O → Fe(OH)₃ + 3HCl
Diese Synthesemethoden bieten Möglichkeiten zur Gewinnung von Fe(OH)₃ für verschiedene Anwendungen, einschließlich Pharmazeutika, Wasseraufbereitung und als Pigment in Farben. Es ist wichtig, während des Syntheseprozesses die richtigen Sicherheitsvorkehrungen zu befolgen und verantwortungsvoll mit Chemikalien umzugehen.
Verwendung von Eisen(III)-hydroxid
Fe(OH)₃ hat aufgrund seiner einzigartigen Eigenschaften mehrere Anwendungen. Hier sind einige häufige Verwendungen von Fe(OH)₃:
- Pharmazeutische Industrie: Die pharmazeutische Industrie verwendet Fe(OH)₃ zur Herstellung von Eisenpräparaten und Medikamenten, beispielsweise zur Behandlung von Eisenmangelanämie.
- Wasseraufbereitung: Wasseraufbereitungsprozesse verwenden Fe(OH)₃, um Verunreinigungen und Verunreinigungen zu entfernen. Fe(OH)₃ wirkt als Flockungsmittel und hilft dabei, im Wasser suspendierte Partikel zu agglomerieren und zu entfernen.
- Pigment in Farben: Fe(OH)₃ findet mit seiner braunen Farbe Anwendung als Pigment in Farben, Beschichtungen und Farbstoffen. Es verleiht eine Reihe erdiger Farbtöne und eignet sich besonders zur Herstellung von Ocker- und Siena-Farben.
- Abwasserbehandlung: Kläranlagen verwenden Fe(OH)₃, um Phosphate und Schwermetallverunreinigungen aus Industrieabwässern zu entfernen.
- Katalyse: Fe(OH)₃ fungiert als Katalysator bei verschiedenen chemischen Reaktionen, einschließlich der Zersetzung von Wasserstoffperoxid und Oxidationsreaktionen.
- Adsorptionsmittel: Fe(OH)₃ dient als Adsorptionsmaterial zur Entfernung von Verunreinigungen, Verunreinigungen und Farbstoffen aus Lösungen.
- Bodenverbesserung: Fe(OH)₃ wirkt als Bodenverbesserung, um die Bodenfruchtbarkeit und Nährstoffverfügbarkeit zu verbessern. Es verbessert die Nährstoffspeicherkapazität des Bodens und liefert essentielles Eisen für das Pflanzenwachstum.
- Laborreagenz: Im Labor verwenden Forscher und Analysten Fe(OH)₃ als Reagenz für eine Vielzahl von Analyse- und Forschungszwecken, einschließlich Fällungsreaktionen und pH-Anpassung.
Die vielseitigen Anwendungen von Fe(OH)₃ unterstreichen seine Bedeutung in verschiedenen Branchen und seinen Beitrag zu verschiedenen Prozessen, die von Pharmazeutika bis hin zur Umwelthygiene reichen.
Fragen:
F: Was ist das richtige Gewicht für die Eisen(III)-hydroxid-Formel?
A: Das korrekte Formelgewicht für Fe(OH)₃ beträgt ungefähr 106,867 g/mol.
F: Wie lautet die vollständige Ionengleichung für die Reaktion zwischen FeBr3 und Bariumhydroxid?
A: Die vollständige Ionengleichung für die Reaktion zwischen FeBr3 und Bariumhydroxid lautet FeBr₃ + 3Ba(OH)₂ → 3BaBr₂ + Fe(OH)₃.
F: Welche Masse an Eisen(III)-hydroxid-Niederschlag kann durch die Reaktion von 75,0 ml erzeugt werden?
A: Um die Masse des Fe(OH)₃-Niederschlags zu bestimmen, sind zusätzliche Informationen wie die Konzentration oder Molarität der Reaktanten notwendig.
F: Wie bilde ich Eisen(III)-hydroxid?
A: Fe(OH)₃ kann durch eine Vielzahl von Methoden gebildet werden, einschließlich Fällungsreaktionen zwischen Eisensalzen und Basen, Oxidation von Fe(OH)2 oder Hydrolyse einer Eisensalzlösung.
F: Ist Eisen(III)-hydroxid löslich?
A: Nein, Fe(OH)₃ ist nicht wasserlöslich. Beim Auflösen in Wasser bildet es einen Niederschlag.
F: Wie viele Gramm Fe(OH)₃ sind in 4,61 Gramm Fe³⁺ enthalten?
A: Zur Bestimmung der Gramm Fe(OH)₃ sind die Molmasse von Fe³⁺ und die Stöchiometrie der Reaktion erforderlich.
F: Welche Farbe hat Fe(OH)₃?
A: Fe(OH)₃ hat im Allgemeinen eine braune Farbe.
F: Ist Eisenhydroxid ein Feststoff?
A: Ja, Eisenhydroxid liegt in fester Form vor.
F: Was entsteht durch thermisch zersetztes Eisenhydroxid?
A: Thermisch zersetztes Fe(OH)₃ erzeugt Eisen(III)-oxid (Fe₂O₃) und Wasser.
F: Ist Eisenhydroxid wasserlöslich?
A: Nein, Eisenhydroxid ist nicht wasserlöslich. Beim Mischen mit Wasser bildet es einen Niederschlag.
