EDTA ist eine Polycarbonsäure, die Metallionen chelatisieren kann. Es hat die Formel [CH2N(CH2CO2H)2]2. Es hilft, Schwermetalle aus dem Körper auszuscheiden. EDTA konserviert auch Blutproben und Lebensmittel.
| Nennen Sie Iupac | 2,2′,2″,2″‚-(Ethan-1,2-diyldiammonia)dinatriumtetraacetat |
| Molekularformel | C10H14N2Na2O8 |
| CAS-Nummer | 139-33-3 |
| Synonyme | Dinatriumsalz der (Ethylendinitrilo)tetraessigsäure, Dinatriumedetat, Dinatrium-EDTA, Dinatriumedetat, Dinatrium-EDTA, Dinatriumsalz der EDTA, Disoidsalz der Ethylenbis(iminodiessigsäure), N,N‘-1,2-Ethandiylbis [N-(carboxymethyl). )Glycin], Dinatriumsalz, Na2-EDTA, Na2H2EDTA |
| Inchi | InChI=1S/C10H16N2O8.2Na/c13-7(14)3-11(4-8(15)16)1-2-12(5-9(17)18)6-10(19)20;;/ h1-6H2,(H,13,14)(H,15,16)(H,17,18)(H,19,20);;/q;2*+1/p-2 |
Eigenschaften von EDTA
EDTA-Formel
EDTA steht für Ethylendiamintetraessigsäure, eine synthetische organische Verbindung, die Metallionen chelatisieren kann. Die Formel von EDTA lautet C10H16N2O8, was bedeutet, dass es in seinem Molekül 10 Kohlenstoffatome, 16 Wasserstoffatome, 2 Stickstoffatome und 8 Sauerstoffatome enthält.
EDTA Molmasse
Die Molmasse von Dinatriumedetat ist die Summe der Atommassen aller Atome in seiner Formel. Die Atommassen von Kohlenstoff, Wasserstoff, Stickstoff und Sauerstoff betragen 12,01 g/mol, 1,01 g/mol, 14,01 g/mol bzw. 16,00 g/mol. . Daher beträgt die Molmasse von Edetatdinatrium (10 x 12,01) + (16 x 1,01) + (2 x 14,01) + (8 x 16,00) = 292,24 g/mol.
Siedepunkt von EDTA
Der Siedepunkt eines Stoffes ist die Temperatur, bei der er vom flüssigen in den gasförmigen Zustand übergeht. Der Siedepunkt von Dinatriumedetat ist nicht einfach zu messen, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Einige Quellen schätzen jedoch, dass der Siedepunkt von Dinatriumedetat bei etwa 614,2 °C bei einem Druck von 760 mmHg liegt.
EDTA-Schmelzpunkt
Der Schmelzpunkt eines Stoffes ist die Temperatur, bei der er vom festen in den flüssigen Zustand übergeht. Der Schmelzpunkt von Dinatriumedetat hängt vom Hydratations- und Kristallisationsgrad ab. Die wasserfreie Form von Dinatriumedetat hat einen Schmelzpunkt von etwa 240 °C, während die Dihydratform einen Schmelzpunkt von etwa 248 °C hat.
EDTA-Dichte g/ml
Die Dichte eines Stoffes ist die Masse pro Volumeneinheit. Die Dichte von Dinatriumedetat variiert auch je nach Hydratations- und Kristallisationsgrad. Die wasserfreie Form von Dinatriumedetat hat eine Dichte von etwa 0,86 g/ml, während die Dihydratform eine Dichte von etwa 1,6 g/ml aufweist.
EDTA-Molekulargewicht
Das Molekulargewicht einer Substanz ist ein anderer Begriff für ihre Molmasse, also die Masse eines Mols der Substanz. Wie oben erwähnt beträgt die Molmasse von Dinatriumedetat 292,24 g/mol, daher beträgt sein Molekulargewicht ebenfalls 292,24 g/mol.
Struktur von EDTA
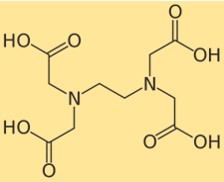
Die Struktur von Dinatriumedetat zeigt, wie seine Atome in seinem Molekül angeordnet und gebunden sind. Dinatriumedetat hat eine zentrale Ethylendiamingruppe, an die vier Carbonsäuregruppen gebunden sind. Jede Carbonsäuregruppe kann ein Proton abgeben und eine negative Ladung bilden, die sich an ein Metallion binden kann. Die Struktur von Dinatriumedetat kann durch das folgende Diagramm dargestellt werden:
Löslichkeit von EDTA
Die Löslichkeit eines Stoffes ist die Menge, die sich in einem bestimmten Lösungsmittel bei einer bestimmten Temperatur und einem bestimmten Druck lösen kann. Die Löslichkeit von Dinatriumedetat hängt vom pH-Wert und dem Vorhandensein von Metallionen in der Lösung ab. Dinatriumedetat ist in alkalischen Lösungen löslicher als in sauren Lösungen, da es mehr negative Ladungen bildet, die mit Wassermolekülen interagieren können. Dinatriumedetat kann auch Komplexe mit Metallionen bilden, die je nach Stabilität und Ladung des Komplexes seine Löslichkeit erhöhen oder verringern können. Beispielsweise beträgt die Löslichkeit von Dinatriumedetat in Wasser bei pH 7 und 25 °C etwa 0,5 M (186 mg/ml), während die Löslichkeit seines Calciumkomplexes etwa 0,02 M (7 mg/ml) beträgt.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifische Dichte | Nicht verfügbar |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 292,24 g/Mol |
| Dichte | 1,6 g/ml (Dihydrat), 0,86 g/ml (wasserfrei) |
| Fusionspunkt | 248°C (Dihydrat), 240°C (wasserfrei) |
| Siedepunkt | 614,2°C (zersetzt sich) |
| Blitzpunkt | 325,2°C |
| Löslichkeit in Wasser | 0,5 M (186 mg/ml) bei pH 7 und 25 °C |
| Löslichkeit | Löslich in alkalischen Lösungen, unlöslich in organischen Lösungsmitteln |
| Dampfdruck | 3,77 x 10^-12 mmHg bei 25°C |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | 2,0, 2,7, 6,2, 10,3 |
| pH-Wert | 4 bis 6 (0,26 M Lösung) |
Sicherheitsrisiken von EDTA
Dinatriumedetat ist eine synthetische organische Verbindung, die Metallionen chelatisieren kann. Seine Anwendungen sind vielfältig in den Bereichen Medizin, Industrie, Landwirtschaft und Forschung. Allerdings birgt es auch gewisse Risiken für die menschliche Gesundheit und die Umwelt, wenn es unsachgemäß gehandhabt wird.
Dinatriumedetat kann bei Kontakt Haut und Augen reizen. Bei Verschlucken kann es außerdem zu Übelkeit, Erbrechen, Durchfall und Bauchschmerzen kommen. Beim Einatmen kann es die Atemwege schädigen. Bei Aufnahme in den Körper kann es Blutzellen und Nieren schädigen. In großen Dosen kann es tödlich sein.
Dinatriumedetat kann auch Boden und Wasser verunreinigen, wenn es in die Umwelt gelangt. Es kann sich an essentielle Metalle binden und deren Verfügbarkeit für Pflanzen und Tiere beeinträchtigen. Es kann biologische Prozesse stören, die von Metallionen abhängen.
Verwenden Sie Dinatriumedetat mit Vorsicht und mit geeigneter Schutzausrüstung. Bewahren Sie es an einem kühlen, trockenen und gut belüfteten Ort auf. Entsorgen Sie es gemäß den örtlichen Vorschriften.
| Gefahrensymbole | |
| Sicherheitsbeschreibung | S24/25: Kontakt mit Haut und Augen vermeiden |
| UN-Identifikationsnummern | UN3077 (fest), UN3082 (flüssig) |
| HS-Code | 29224985 |
| Gefahrenklasse | 9 (verschiedene gefährliche Stoffe) |
| Verpackungsgruppe | III (geringe Gefahr) |
| Toxizität | Orale LD50-Ratte: 2000 mg/kg |
EDTA-Synthesemethoden
Es gibt verschiedene Methoden zur Synthese von Dinatriumedetat, die gebräuchlichste ist jedoch die Kondensation von Ethylendiamin mit Chloressigsäure oder ihrem Natriumsalz.
Die Reaktion umfasst zwei Schritte: Erstens bildet der nukleophile Angriff von Ethylendiamin auf Chloressigsäure oder deren Natriumsalz ein Monoamid-Zwischenprodukt. Zweitens entsteht durch die Entfernung von Salzsäure oder Natriumchlorid eine Carbonsäuregruppe. Zur Bildung von Dinatriumedetat kann es mit einem weiteren Äquivalent Chloressigsäure oder ihrem Natriumsalz umgesetzt werden.
Eine weitere Methode zur Synthese von Dinatriumedetat ist die Oxidation von Ethylendiamin mit Natriumhypochlorit in einer alkalischen Lösung. Bei dieser Methode entstehen Dinatriumedetat als Natriumsalz und Ammoniak als Nebenprodukt.
Andere Methoden zur Synthese von Dinatriumedetat umfassen die Reaktion von Ethylendiamin mit Formaldehyd und Natriumcyanid oder die Reaktion von Ethylendiamin mit Glyoxylsäure oder ihren Estern.
Verwendungsmöglichkeiten von EDTA
Dinatriumedetat ist eine synthetische organische Verbindung, die Metallionen chelatisieren kann. Es hat vielfältige Einsatzmöglichkeiten in unterschiedlichen Bereichen und Branchen. Einige der Anwendungen von Edetat-Dinatrium sind:
- In der Medizin kann Dinatriumedetat zur Behandlung von Schwermetallvergiftungen eingesetzt werden, indem es toxische Metalle bindet und diese aus dem Körper entfernt. Es kann auch Blutgerinnseln und Verkalkungen der Arterien vorbeugen, indem es Kalziumionen chelatisiert.
- In Lebensmitteln und Getränken kann Dinatriumedetat die Farbe, den Geschmack und die Textur von Produkten bewahren, indem es Oxidation und Ranzigkeit verhindert. Es kann auch Verfärbungen und Beschädigungen durch Metallionen verhindern.
- In Kosmetika und Körperpflegeprodukten kann Dinatriumedetat die Stabilität und Wirksamkeit von Produkten verbessern, indem es mikrobielles Wachstum und metallkatalysierte Reaktionen verhindert. Es kann auch das Aussehen und die Haptik von Produkten verbessern, indem es Mineralien chelatisiert, die für die Wasserhärte verantwortlich sind.
- In Industrie und Forschung kann Edetat-Dinatrium die Leistung und Qualität von Produkten und Prozessen verbessern, indem es störende Metallionen chelatisiert. Beispielsweise kann es Kalkablagerungen in Kesseln und Rohren verhindern, das Färben und Bedrucken von Textilien verbessern, Rost und Flecken von Metallen entfernen sowie den pH-Wert und die Metallkonzentration in Analysemethoden steuern.
Fragen:
F: Was ist EDTA?
A: Dinatriumedetat ist eine synthetische organische Verbindung, die Metallionen chelatisieren kann. Es steht für Ethylendiamintetraessigsäure.
F: Wie bereite ich eine EDTA-Lösung vor?
A: Um eine Edetat-Dinatriumlösung herzustellen, wiegen Sie die gewünschte Menge Edetat-Dinatrium ab und lösen Sie sie in destilliertem Wasser auf. Stellen Sie den pH-Wert mit Natriumhydroxid auf 8,0 ein.
F: Wie löst man EDTA in Wasser auf?
A: Dinatriumedetat ist wasserlöslich, löst sich jedoch langsam auf. Um Dinatriumedetat in Wasser aufzulösen, erhitzen Sie das Wasser auf etwa 80 °C und rühren Sie die Mischung, bis sich das Dinatriumedetat vollständig aufgelöst hat.
F: Wie bereite ich 0,5 M EDTA vor?
A: Um 0,5 M Dinatriumedetat herzustellen, wiegen Sie 73,06 g Dinatriumedetat ab und lösen Sie es in 800 ml destilliertem Wasser auf. Stellen Sie den pH-Wert mit Natriumhydroxid auf 8,0 ein und verdünnen Sie die Lösung mit destilliertem Wasser auf 1 l.
F: Was macht EDTA?
A: Dinatriumedetat bindet an Metallionen und bildet mit ihnen stabile Komplexe. Dadurch wird verhindert, dass Metallionen mit anderen Substanzen reagieren oder analytische Methoden stören.
F: Was bedeutet EDTA?
A: Dinatriumedetat bedeutet Ethylendiamintetraessigsäure, das ist der Name der Verbindung mit der Formel [CH2N(CH2CO2H)2]2.
F: Wie berechnet man die Wasserhärte durch EDTA-Titration?
A: Um die Wasserhärte durch Edetat-Dinatrium-Titration zu berechnen, titrieren Sie ein bekanntes Volumen einer Wasserprobe mit einer Standard-Edetat-Dinatriumlösung unter Verwendung eines geeigneten Indikators. Notieren Sie die Menge des verwendeten Dinatriumedetats und verwenden Sie die folgende Formel: Härte (mg/L als CaCO3) = (Volumen von EDTA x Molarität von EDTA x 1000) / Volumen der Wasserprobe
