Kupfer(I)-sulfid (Cu2S) ist eine schwarze feste Verbindung. Es wird als Halbleiter und Katalysator vom P-Typ in verschiedenen industriellen Anwendungen wie Solarzellen und der Wasserstoffproduktion eingesetzt.
| IUPAC-Name | Kupfersulfid(1+) |
| Molekularformel | Cu2S |
| CAS-Nummer | 22205-45-4 |
| Synonyme | Kupfermonosulfid, Kupfersulfid, Kupfersulfid (1+), Kupfersulfid, Kupfersulfid, Kupfersulfid |
| InChI | InChI=1S/2Cu.S/q2*+1;-2 |
Molmasse von Kupfer(I)-sulfid
Kupfer(I)sulfid hat eine Molmasse von 159,16 g/mol. Die Molmasse ist die Masse eines Mols einer Substanz, berechnet durch Addition der Atommassen der in der Verbindung vorhandenen Elemente. Kupfer(I)-sulfid besteht aus zwei Kupferatomen und einem Schwefelatom mit jeweils eigener Atommasse. Die Kenntnis der Molmasse ist bei verschiedenen chemischen Berechnungen wichtig, beispielsweise bei der Bestimmung der Menge einer Substanz, die für eine bestimmte Reaktion benötigt wird, oder bei der Ermittlung der empirischen Formel einer Verbindung.
Siedepunkt von Kupfer(I)-sulfid
Kupfer(I)-sulfid hat einen hohen Schmelzpunkt von 1103 °C, aber keinen ausgeprägten Siedepunkt. Dies liegt daran, dass sich Kupfer(I)-sulfid beim Erhitzen auf hohe Temperaturen zersetzt, anstatt zu sieden. Bei der Zersetzung von Kupfer(I)-sulfid entstehen Kupfergas und Kupfersulfid, die dann gesammelt und analysiert werden können. Das Fehlen eines Siedepunkts für Kupfer(I)sulfid ist für viele feste Verbindungen, die sich beim Erhitzen zersetzen, nicht ungewöhnlich.
Schmelzpunkt von Kupfer(I)sulfid
Kupfer(I)sulfid hat einen Schmelzpunkt von 1103°C. Der hohe Schmelzpunkt ist auf die starke ionische Bindung zwischen den Kupfer- und Schwefelatomen in der Kristallgitterstruktur der Verbindung zurückzuführen. Der hohe Schmelzpunkt von Kupfer(I)-sulfid macht es nützlich für Hochtemperaturanwendungen, beispielsweise in Solarzellen, wo es als p-Typ-Halbleiter fungiert.
Dichte von Kupfer(I)-sulfid g/ml
Kupfer(I)sulfid hat eine Dichte von 5,6 g/ml. Die Dichte eines Stoffes ist die Masse eines Stoffes pro Volumeneinheit. Die hohe Dichte von Kupfer(I)-sulfid ist auf die in der Verbindung vorhandenen schweren Atome sowie auf seine Kristallstruktur zurückzuführen. Aufgrund der hohen Dichte von Kupfer(I)-sulfid eignet es sich für vielfältige Anwendungen, unter anderem als Pigment in Keramik und Glas.
Molekulargewicht von Kupfer(I)-sulfid
Das Molekulargewicht von Kupfer(I)sulfid beträgt 159,16 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül. Kupfer(I)-sulfid hat eine einfache chemische Formel, die aus zwei Kupferatomen und einem Schwefelatom besteht, sodass sein Molekulargewicht relativ einfach zu berechnen ist. Das Molekulargewicht einer Verbindung ist für verschiedene chemische Berechnungen wichtig, beispielsweise für die Bestimmung der Stöchiometrie einer Reaktion oder die Ermittlung der Summenformel einer Verbindung.
Struktur von Kupfer(I)-sulfid
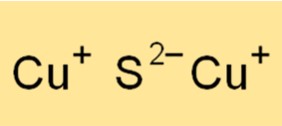
Kupfer(I)-sulfid hat eine kubisch-flächenzentrierte (fcc) Kristallgitterstruktur. Die Kristallstruktur besteht aus Kupfer- und Schwefelatomen, wobei jedes Kupferatom von vier Schwefelatomen umgeben ist, die in einer tetraedrischen Anordnung angeordnet sind. Die starke ionische Bindung zwischen Kupfer- und Schwefelatomen führt zu einer stabilen Kristallstruktur mit hohem Schmelzpunkt. Die Kristallstruktur von Kupfer(I)-sulfid ist wichtig für das Verständnis seiner physikalischen und chemischen Eigenschaften sowie seiner verschiedenen Anwendungen.
Kupfer(I)-Sulfid-Formel
Die chemische Formel für Kupfer(I)-sulfid lautet Cu2S, was darauf hinweist, dass die Verbindung aus zwei Kupferatomen und einem Schwefelatom besteht. Die Formel einer Verbindung gibt Auskunft über die vorhandenen Elemente und die Anzahl der Atome jedes Elements in der Verbindung. Die Formel für Kupfer(I)-sulfid ist für verschiedene chemische Berechnungen nützlich, beispielsweise zur Bestimmung des Molverhältnisses von Kupfer und Schwefel in der Verbindung oder zur Ermittlung der empirischen Formel der Verbindung.
| Aussehen | Tiefes Schwarz |
| Spezifisches Gewicht | 5,6 g/ml |
| Farbe | Schwarz |
| Geruch | Geruchlos |
| Molmasse | 159,16 g/Mol |
| Dichte | 5,6 g/ml |
| Fusionspunkt | 1103°C |
| Siedepunkt | Zersetzt sich beim Erhitzen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Unlöslich |
| Löslichkeit | Unlöslich in Wasser und organischen Lösungsmitteln |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Kupfer(I)sulfid (Cu2S) Sicherheit und Gefahren
Kupfer(I)-sulfid (Cu2S) gilt im Allgemeinen als sicher in der Handhabung, da es eine stabile, nicht reaktive feste Verbindung ist. Wie bei allen Chemikalien muss jedoch mit Vorsicht vorgegangen werden, um eine versehentliche Exposition zu vermeiden. Das Einatmen von Staub oder Dämpfen der Verbindung sollte vermieden werden, da dies zu Reizungen der Atemwege führen kann. Hautkontakt mit Kupfer(I)sulfid (Cu2S) kann ebenfalls Reizungen oder allergische Reaktionen hervorrufen. Deshalb sollten beim Umgang Handschuhe und andere Schutzkleidung getragen werden. Im Falle einer versehentlichen Einnahme sollte sofort ein Arzt aufgesucht werden. Um Umweltgefahren zu vermeiden, sollten ordnungsgemäße Handhabungs-, Lagerungs- und Entsorgungsverfahren befolgt werden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Einatmen und Hautkontakt vermeiden. Schutzkleidung tragen. |
| UN-Identifikationsnummern | Nicht reguliert |
| HS-Code | 284290 |
| Gefahrenklasse | Nicht als gefährlich eingestuft |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität |
Methoden zur Synthese von Kupfer(I)-sulfid (Cu2S)
Es gibt verschiedene Methoden zur Synthese von Kupfer(I)-sulfid (Cu2S), darunter:
- Direkte Synthesemethode: Dabei wird Kupferpulver mit Schwefel bei hoher Temperatur in einer inerten Atmosphäre zur Bildung von Kupfer(I)-sulfid umgesetzt.
- Solvothermale Methode: Dabei wird eine Mischung aus Kupferacetat und Thioharnstoff in einem Lösungsmittel bei hohen Temperaturen und Drücken erhitzt, um Kupfer(I)-sulfidpartikel zu bilden.
- Hydrothermale Methode: Dabei werden Kupfersalze und Schwefel in einer wässrigen Lösung bei hohen Temperaturen und Drücken zu Kupfer(I)-sulfid umgesetzt.
- Chemische Gasphasenabscheidungsmethode: Dabei wird ein kupferhaltiger Vorläufer in einer schwefelhaltigen Gasumgebung zersetzt, um Kupfer(I)-Sulfidfilme zu bilden.
- Sprühpyrolyseverfahren: Dabei wird eine Lösung aus Kupfersalzen und Schwefel auf ein erhitztes Substrat gesprüht, um einen dünnen Film aus Kupfer(I)sulfid zu bilden.
- Co-Fällungsmethode: Hierbei werden Kupfer- und Schwefelionen gleichzeitig in einer wässrigen Lösung unter Verwendung eines geeigneten Fällungsmittels zu Kupfer(I)-sulfid ausgefällt.
- Elektrochemische Methode: Dabei wird mithilfe einer elektrochemischen Zelle Kupfer(I)-sulfid aus einer Lösung, die Kupfer- und Schwefelionen enthält, auf einem Substrat abgeschieden.
Diese Methoden bieten unterschiedliche Kontrolle über die Größe, Form und Eigenschaften der resultierenden Kupfer(I)-Sulfid-Partikel oder -Filme, wodurch sie für verschiedene Anwendungen nützlich sind.
Kupfer(I)-sulfid (Cu2S)
Kupfer(I)-sulfid (Cu2S) ist eine nützliche Verbindung mit vielfältigen Anwendungen in verschiedenen Bereichen. Hier sind einige seiner Verwendungsmöglichkeiten:
- Photovoltaikzellen: Wird bei der Herstellung von Photovoltaikzellen verwendet. Zur Stromerzeugung werden Photovoltaikzellen eingesetzt.
- Pigmente: Wird als Pigment bei der Herstellung verschiedener Produkte verwendet, darunter Keramik, Glas und Kunststoffe. Es bietet eine tiefschwarze Farbe, die dem Ausbleichen und Witterungseinflüssen widersteht.
- Schmierstoffe: Wird aufgrund seines niedrigen Reibungskoeffizienten in verschiedenen Anwendungen als Schmiermittel eingesetzt. Es ist besonders nützlich in Umgebungen mit hohen Temperaturen und hohem Druck.
- Halbleiter: Wird als Halbleitermaterial in elektronischen und optoelektronischen Anwendungen verwendet. Es verfügt über einzigartige optische und elektronische Eigenschaften, die es für verschiedene Anwendungen geeignet machen, darunter Photovoltaikzellen, Sensoren und Detektoren.
- Fungizide: Wird in der Landwirtschaft als Fungizid eingesetzt, um Nutzpflanzen vor Pilzkrankheiten zu schützen. Es ist eine wirksame und ökologische Alternative zu herkömmlichen chemischen Fungiziden.
- Anorganische Pigmente: Werden zur Herstellung anorganischer Pigmente verwendet. Diese Pigmente werden bei der Herstellung von farbigem Glas, Keramik und Emaille verwendet. Seine tiefschwarze Farbe ist lichtbeständig und witterungsbeständig, was es zu einer beliebten Wahl für langlebige Pigmente macht.
Fragen:
F: Was ist Cu2S?
A: Cu2S ist die chemische Formel für Kupfer(I)-sulfid, eine Kupfersulfidverbindung, die häufig in verschiedenen Anwendungen verwendet wird, darunter Photovoltaikzellen, Pigmente, Halbleiter und Fungizide.
F: Was entsteht beim Erhitzen einer Mischung aus Cu2O und Cu2S?
A: Das Erhitzen einer Mischung aus Cu2O und Cu2S führt zu einer Mischung aus Kupfergas und Schwefeldioxid sowie eventuell verbleibendem nicht umgesetztem Cu2O oder Cu2S.
F: Wie heißt die Cu2S-Verbindung? A: Der Name der Cu2S-Verbindung ist Kupfer(I)-sulfid.
