Das Carbonation CO32- ist ein negativ geladenes Ion, das aus einem Kohlenstoffatom, drei Sauerstoffatomen und einer Gesamtladung von -2 besteht. Es kommt häufig in Mineralien wie Calcit und Dolomit sowie in wässrigen Lösungen als Bicarbonat vor. Es spielt eine entscheidende Rolle bei der Kontrolle des pH-Werts im Meer und anderen Gewässern.
| IUPAC-Name | Carbonat-Ion |
| Molekularformel | CO32- |
| CAS-Nummer | 497-19-8 |
| Synonyme | Kohlensäure, Kohlentrioxid |
| InChI | InChI=1S/CH2O3.2K/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Eigenschaften von Carbonationen
Carbonat-Formel
Die Formel für das Carbonation wird durch CO3^2- dargestellt, wobei C für Kohlenstoff, O für Sauerstoff und das Symbol 2- für die negative Ladung des Ions steht. Diese Formel besagt, dass das Carbonation drei Sauerstoffatome und ein Kohlenstoffatom enthält, was ihm seine charakteristische Molekülstruktur verleiht.
CO3-Karbonatladung
Das Carbonation CO3^2- hat aufgrund der Anwesenheit von drei Sauerstoffatomen und einem Kohlenstoffatom in seiner chemischen Formel eine negative Ladung 2. Die negative Ladung resultiert aus der Anwesenheit zusätzlicher Elektronen im Carbonation, was es zu einem negativ geladenen Ion macht.
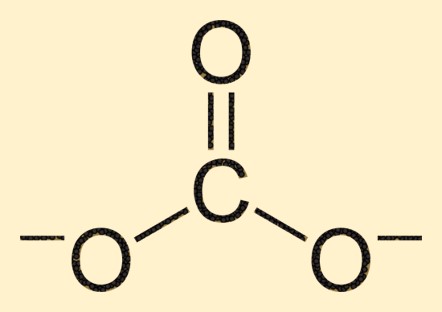
Karbonatstruktur
Das Carbonation besteht aus einem Kohlenstoffatom in seinem Zentrum, das von drei Sauerstoffatomen in einer trigonal-planaren Anordnung umgeben ist. Das Kohlenstoffatom bildet mit einem Sauerstoffatom eine Doppelbindung, während die beiden anderen Sauerstoffatome über Einfachbindungen mit dem Kohlenstoffatom verbunden sind. Diese Struktur verleiht dem CO3 2- Ion seine charakteristische Form und Eigenschaften.
Molekulargewicht des Carbonat-Ions
Das Molekulargewicht des Carbonations beträgt etwa 60,01 g/mol, berechnet auf der Grundlage der Atomgewichte seiner Bestandteile (Kohlenstoff, Sauerstoff). Das Molekulargewicht der Kohlensäure ist wichtig für die Bestimmung der Kohlensäuremenge in einer Probe sowie für die Bestimmung ihrer physikalischen und chemischen Eigenschaften.
| Aussehen | Festes weißes Pulver |
| Spezifisches Gewicht | 2.5 |
| Farbe | Weiß |
| Geruch | Keiner |
| Molmasse | 100,09 g/Mol |
| Dichte | 2,83 g/cm3 |
| Fusionspunkt | 825°C |
| Siedepunkt | 1484°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | In Wasser löslich |
| Löslichkeit | Löslich in Säuren |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| PKa | 10:33 Uhr |
| PH | 8.6 |
Sicherheit und Gefahren von Carbonationen
Das Carbonation CO32- wird in verschiedenen Branchen häufig verwendet, muss jedoch mit Vorsicht gehandhabt werden. Das Einatmen hoher Mengen an Karbonatstaub kann Atembeschwerden verursachen, während die Einnahme großer Mengen zu Verdauungsproblemen führen kann. Bei Hautkontakt kann es zu Reizungen und Hautläsionen kommen. Es ist außerdem brennbar und kann mit anderen Chemikalien reagieren, wodurch gefährliche Gase entstehen. Es ist wichtig, Sicherheitsmaßnahmen zu befolgen, wie das Tragen persönlicher Schutzausrüstung und die Lagerung von Carbonationen in geeigneten Behältern, um das Risiko von Unfällen zu minimieren.
| Gefahrensymbol | Keiner |
| Sicherheitsbeschreibung | Es gilt nicht als gefährlich und ist nicht mit bestimmten Gefahrensymbolen verbunden. |
| EINE ID | N / A |
| HS-Code | N / A |
| Gefahrenklasse | N / A |
| Verpackungsgruppe | N / A |
| Toxizität | Ungiftig |
Methoden der Carbonationen-Synthese
Carbonationen (CO3 2- ) können mit verschiedenen Methoden synthetisiert werden. Die gebräuchlichste Methode zur Herstellung von CO3 2- Ionen ist die Reaktion von Kohlendioxid und Wasser. Bei dieser Reaktion entsteht eine Kohlensäurelösung, die dann mit einem Alkali wie Natriumhydroxid neutralisiert werden kann, um Kohlensäure zu erzeugen. Kohlensäure kann auch durch Elektrolyse einer Salzlösung hergestellt werden, wobei sich an der Kathode Carbonationen bilden. Diese Ionen können auch im Labor durch eine chemische Reaktion zwischen einer Säure und einem Carbonatsalz erzeugt werden.
Verwendung von Carbonationen
In der Industrie wird Kohlensäure häufig für verschiedene Zwecke eingesetzt. Backpulverhersteller, Hersteller von Antazida und Getränkehersteller verwenden häufig Kohlensäure in ihren Produkten. Die Wasseraufbereitungsindustrie kontrolliert den pH-Wert in Trinkwasser und Schwimmbädern mithilfe von Karbonationen. Die Bauindustrie verwendet CO3 2- Ionen als Hauptbestandteil von Zement zur Herstellung von Beton. Landwirte fügen dem Boden Karbonationen hinzu, um dessen Alkalität zu verbessern und das Pflanzenwachstum zu fördern. Die chemische Industrie verwendet Carbonationen als Katalysator und Reagenz bei verschiedenen chemischen Reaktionen. Die Lebensmittelindustrie konserviert Lebensmittel durch den Einbau von Carbonationen. Aufgrund ihrer Vielseitigkeit spielen Carbonationen in vielen Alltagsprodukten und industriellen Prozessen eine wesentliche Rolle.
