Chlortrifluorid oder ClF3 ist eine hochreaktive und giftige chemische Verbindung, die in Raketentreibstoffen, Reinigungsmitteln und als Oxidationsmittel bei chemischen Reaktionen verwendet wird. Es kann schwere Verbrennungen verursachen und sich bei Kontakt mit organischen Materialien spontan entzünden.
| IUPAC-Name | Chlortrifluorid |
| Molekularformel | ClF3 |
| CAS-Nummer | 7790-91-2 |
| Synonyme | Chlorfluorid, Trifluorchlor, Trichlorfluorid, Fluorchlor, Chlorylfluorid, Fluorchlorid |
| InChI | InChI=1S/ClF3/c2-1(3)4 |
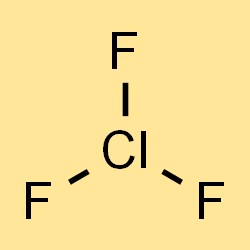
Chlortrifluorid-Formel
Die chemische Formel für Chlortrifluorid lautet ClF3, was die drei Fluoratome und ein Chloratom im Molekül darstellt. Mit der Formel können die Molmasse, die Dichte und andere physikalische Eigenschaften von Chlortrifluorid berechnet werden. Die Formel gibt auch die Art und Anzahl der in der Verbindung vorhandenen Atome an, was für das Verständnis ihrer chemischen Eigenschaften und Reaktivität wichtig ist.
Molmasse von Chlortrifluorid
Die Molmasse von Chlortrifluorid (ClF3) beträgt 92,45 g/mol. Dieser Wert wird durch Addition der Atomgewichte der einzelnen Elemente berechnet, die für Chlor 35,45 g/mol und für Fluor 37,996 g/mol betragen. Die Molmasse von Chlortrifluorid ist wichtig für chemische Berechnungen und zur Bestimmung der Menge der Verbindung in einer bestimmten Probe.
Siedepunkt von Chlortrifluorid
Chlortrifluorid hat bei Normaldruck einen Siedepunkt von 11,75 °C. Dies macht es zu einer flüchtigen und hochreaktiven Verbindung, die leicht verdampfen und giftige Dämpfe bilden kann. Der niedrige Siedepunkt von Chlortrifluorid wird auf die schwachen intermolekularen Kräfte zwischen seinen Molekülen zurückgeführt, die es ihnen ermöglichen, bei relativ niedrigen Temperaturen auseinanderzubrechen und als Gas zu entweichen.
Schmelzpunkt von Chlortrifluorid
Chlortrifluorid hat bei Normaldruck einen Schmelzpunkt von -76,3 °C (-105,3 °F). Dies macht es bei Raumtemperatur und -druck zu einem Feststoff, kann jedoch aufgrund seiner hohen Flüchtigkeit leicht sublimieren und giftige Dämpfe bilden. Der niedrige Schmelzpunkt von Chlortrifluorid wird auf die schwachen intermolekularen Kräfte zwischen seinen Molekülen zurückgeführt, die es ihnen ermöglichen, bei relativ niedrigen Temperaturen auseinanderzubrechen und zu einem Gas zu werden.
Dichte von Chlortrifluorid g/ml
Die Dichte von Chlortrifluorid beträgt 1,77 g/ml bei Standardtemperatur und -druck (STP). Dieser Wert ist höher als der von Luft (1,29 g/ml), was Chlortrifluorid zu einem dichteren Gas als Luft macht. Die hohe Dichte von Chlortrifluorid ist auf sein Molekulargewicht zurückzuführen, das höher ist als das der meisten Gase in der Atmosphäre.
Molekulargewicht von Chlortrifluorid
Das Molekulargewicht von Chlortrifluorid beträgt 92,45 g/mol. Dieser Wert wird durch Addition der Atomgewichte der einzelnen Elemente berechnet, die für Chlor 35,45 g/mol und für Fluor 37,996 g/mol betragen. Das hohe Molekulargewicht von Chlortrifluorid macht es zu einem dichten Gas, das schwerer als Luft ist.
Struktur von Chlortrifluorid
Chlortrifluorid hat eine trigonal-bipyramidale Molekülgeometrie mit einem zentralen Chloratom, das an drei Fluoratome in äquatorialen Positionen gebunden ist, und zwei freien Stellen in axialen Positionen. Diese Struktur führt zu einem polaren Molekül, wobei die beiden axialen Positionen eine teilweise positive Ladung und die drei äquatorialen Positionen eine teilweise negative Ladung aufweisen.
| Aussehen | Farbloses bis blassgelbes Gas oder Flüssigkeit |
| Spezifisches Gewicht | 1,77 |
| Farbe | Farblos bis hellgelb |
| Geruch | Stechender und erstickender Geruch |
| Molmasse | 92,45 g/Mol |
| Dichte | 1,77 g/ml bei STP |
| Fusionspunkt | -76,3 °C (-105,3 °F) |
| Siedepunkt | 11,75°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert heftig mit Wasser |
| Löslichkeit | Löslich in Schwefelsäure, Salpetersäure und anderen Oxidationsmitteln |
| Dampfdruck | 1,73 ATM bei 20°C |
| Wasserdampfdichte | 3,2 (Luft = 1) |
| PKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Chlortrifluorid
Chlortrifluorid ist eine hochreaktive und gefährliche Verbindung. Dies birgt erhebliche Gesundheits- und Sicherheitsrisiken und sollte mit äußerster Vorsicht gehandhabt werden. Bei Kontakt mit Haut, Augen und Schleimhäuten kann es zu schweren Verbrennungen, Verätzungen und Reizungen kommen. Das Einatmen der Dämpfe kann zu Atemnot, Husten und Brustschmerzen führen. Chlortrifluorid kann sich außerdem entzünden und heftig mit organischen Materialien, Metallen und Wasser reagieren, was zu Explosionen und Bränden führen kann. Beim Umgang mit Chlortrifluorid sollten spezielle Schutzausrüstungen wie chemikalienbeständige Anzüge und Atemschutzmasken getragen werden, und diese sollten nur in einer gut belüfteten Umgebung verwendet werden, die von geschulten Fachkräften kontrolliert wird.
| Gefahrensymbole | Ätzend, oxidierend |
| Sicherheitsbeschreibung | Von Hitze, Funken, offenen Flammen, heißen Oberflächen und Zündquellen fernhalten. Tragen Sie Schutzkleidung und -ausrüstung. Kontakt mit Haut, Augen und Kleidung vermeiden. Dämpfe oder Dämpfe nicht einatmen. Nicht einnehmen. Nur in einem gut belüfteten Bereich verwenden. |
| AN-Kennungen | Ein 1749 |
| HS-Code | 281211 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | ICH |
| Toxizität | Sehr giftig |
Methoden zur Synthese von Chlortrifluorid
Durch direkte Fluorierung von Chlorgas kann Chlortrifluorid synthetisiert werden. Fluorwasserstoff und Chlorgas können unter Bildung von Chlortrifluorid reagieren.
Bei der direkten Fluorierung reagiert eine Mischung aus Chlorgas und Fluorgas auf einem Bett aus Aktivkohle oder einem anderen inerten Material bei hoher Temperatur zu Chlortrifluorid.
Eine andere Methode beinhaltet die Reaktion zwischen Fluorwasserstoff und Chlorgas. Bei diesem Verfahren strömen beide Gase bei erhöhten Temperaturen über einen Katalysator, beispielsweise aktiviertes Aluminiumoxid oder Platin. Bei der Reaktion der beiden Gase entstehen als Nebenprodukte Chlortrifluorid und Chlorwasserstoff.
Schwefeltetrafluorid und Chlorgas reagieren in Gegenwart eines Katalysators wie Eisen oder Nickel bei erhöhten Temperaturen, um Chlortrifluorid zu synthetisieren und Schwefeldioxid als Nebenprodukt zu erzeugen.
Aufgrund der Gefährlichkeit von Chlortrifluorid sind für jede dieser Methoden spezielle Geräte und eine sorgfältige Handhabung erforderlich. Die Sicherheit von Personal und Umwelt muss während des Syntheseprozesses durch geeignete Sicherheitsmaßnahmen wie chemikalienbeständige Anzüge und Belüftungssysteme gewährleistet werden.
Verwendung von Chlortrifluorid
Chlortrifluorid (ClF3) findet aufgrund seiner hochreaktiven Natur und starken oxidierenden Eigenschaften mehrere industrielle Anwendungen.
- ClF3 reinigt und ätzt Halbleitermaterialien wie Silizium und Germanium, indem es unerwünschte Verunreinigungen und Verunreinigungen von ihren Oberflächen entfernt.
- ClF3 wandelt Uranoxid in Uranhexafluorid für die Kernbrennstoffproduktion um. Uranhexafluorid wird für den Einsatz in Kernreaktoren angereichert.
- ClF3 erhöht die Verbrennungseffizienz und erzeugt einen größeren Schub, wenn es in Kombination mit anderen Oxidationsmitteln wie Hydrazin oder Wasserstoff in Raketentreibstoffen und hochenergetischen Oxidationsmitteln für Treibstoffsysteme verwendet wird.
- ClF3 hellt Textilien und Papierprodukte auf.
- ClF3 produziert bestimmte Chemikalien wie Fluorgas und Fluorkohlenwasserstoffe.
Aufgrund seiner Gefährlichkeit sollte Chlortrifluorid bei allen seinen Anwendungen mit äußerster Vorsicht und nur von geschulten Fachkräften mit angemessener Sicherheitsausrüstung und -protokollen gehandhabt werden.
Fragen:
F: Ist Chlortrifluorid polar oder unpolar?
A: Chlortrifluorid ist aufgrund der unterschiedlichen Elektronegativität zwischen Chlor- und Fluoratomen ein polares Molekül.
F: Wie löscht man Chlortrifluorid?
A: Chlortrifluorid kann mit trockenem Sand, Graphit oder Natriumchlorid gelöscht werden. Zum Löschen eines Chlortrifluorid-Brandes sollte niemals Wasser verwendet werden, da es heftig reagieren und giftige Gase freisetzen kann.
F: Lewis-Struktur von Chlortrifluorid?
A: Die Lewis-Struktur von ClF3 besteht aus einem zentralen Chloratom, das von drei Fluoratomen umgeben ist. Das Chloratom ist durch eine Einfachbindung mit jedem der drei Fluoratome verbunden, und am Chloratom befindet sich ein einzelnes Elektronenpaar.
F: Welche formale Ladung hat das Chloratom im Chlortrifluorid-Molekül?
A: Die formale Ladung des Chloratoms in Chlortrifluorid ist Null. Das Chloratom verfügt über sieben Valenzelektronen und ist an drei Fluoratome gebunden, die eine höhere Elektronegativität als Chlor aufweisen. Das freie Elektronenpaar am Chloratom ist an keiner Bindung beteiligt und wird daher bei der Bestimmung der Formalladung nicht berücksichtigt.
F: Brand durch Chlortrifluorid?
A: Chlortrifluorid ist eine hochreaktive und brennbare Substanz, die sich bei Kontakt mit organischen Materialien oder sogar Luft spontan entzünden kann. Im Falle eines Chlortrifluorid-Brandes sollte zum Löschen des Feuers trockener Sand, Graphit oder Natriumchlorid verwendet werden. Auf keinen Fall sollte Wasser verwendet werden, da dies zu heftigen Reaktionen führen kann. Auch im Falle eines Chlortrifluorid-Brandes ist es wichtig, den Bereich zu evakuieren und bei Exposition sofort einen Arzt aufzusuchen.
