Chromsäure ist ein starkes, ätzendes Oxidationsmittel, das in einer Vielzahl von Anwendungen eingesetzt wird, beispielsweise bei der Metallreinigung, beim Gravieren und in einigen Laborexperimenten. Es hat eine rote Farbe.
| IUPAC-Name | Chromsäure |
| Molekularformel | H2CrO4 |
| CAS-Nummer | 7738-94-5 |
| Synonyme | Chrom(VI)-Säure, Chromsäure, Dihydroxydioxydochrom, Dihydrogen (Tetraoxydochromat) |
| InChI | InChI=1S/Cr.H2O4/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Eigenschaften von Chromsäure
Chromsäure-Formel
Die chemische Formel für Chromsäure lautet H2CrO4. Es besteht aus zwei Wasserstoffatomen, einem Chromatom und vier Sauerstoffatomen. Die Formel stellt die Zusammensetzung der Chromsäure auf molekularer Ebene dar.
Molmasse der Chromsäure
Die Molmasse von Chromsäure kann durch Addition der Atommassen ihrer Bestandteile berechnet werden. Chrom hat eine Atommasse von 51,996 Gramm pro Mol, Wasserstoff hat eine Molmasse von 1,008 Gramm pro Mol und Sauerstoff hat eine Molmasse von 16,00 Gramm pro Mol. Daher beträgt die Molmasse von Chromsäure etwa 118,00 Gramm pro Mol.
Siedepunkt von Chromsäure
Chromsäure hat keinen eindeutigen Siedepunkt, da sie sich beim Erhitzen zersetzt und Sauerstoffgas freisetzt. Seine Zersetzungstemperatur liegt jedoch bei etwa 190 °C (374 °F). Beim Erhitzen geht Chromsäure eine chemische Reaktion ein, die zur Bildung von Chromtrioxid und Wasser führt.
Schmelzpunkt von Chromsäure
Der Schmelzpunkt von Chromsäure ist nicht genau definiert, da sie dazu neigt, sich vor dem Schmelzen zu zersetzen. Es ist jedoch bekannt, dass sich Chromsäure je nach Bedingungen bei etwa 250 °C (482 °F) oder sogar noch niedrigeren Temperaturen zersetzen kann.
Dichte von Chromsäure g/ml
Chromsäure hat bei Raumtemperatur eine Dichte von etwa 1,2 Gramm pro Milliliter (g/ml). Dieser Dichtewert zeigt an, dass Chromsäure im Vergleich zu Wasser relativ dicht ist.
Molekulargewicht der Chromsäure
Das Molekulargewicht von Chromsäure wird durch Addition der Atommassen ihrer Bestandteile berechnet. In diesem Fall beträgt das Molekulargewicht etwa 118,00 Gramm pro Mol.
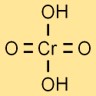
Struktur von Chromsäure
Die Struktur der Chromsäure wird durch ein zentrales Chromatom dargestellt, das an vier Sauerstoffatome und zwei Wasserstoffatome gebunden ist. Die Sauerstoffatome sind tetraedrisch um das Chromatom angeordnet.
Löslichkeit von Chromsäure
Chromsäure ist in Wasser mäßig löslich, was bedeutet, dass sie sich bis zu einem gewissen Grad auflösen kann. Die Löslichkeit nimmt mit steigender Temperatur zu. Allerdings muss vorsichtig damit umgegangen werden, da es sich um eine ätzende Substanz handelt.
| Aussehen | Dunkelrote Kristalle |
| Spezifisches Gewicht | 2,70 |
| Farbe | Rot |
| Geruch | Geruchlos |
| Molmasse | 118,01 g/Mol |
| Dichte | 1.201 g/ml |
| Fusionspunkt | Zersetzt sich bei ~190°C |
| Siedepunkt | Zersetzt sich bei ~250°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Wasser und organischen Lösungsmitteln wie Ethanol, Ether |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | -0,64 |
| pH-Wert | Sehr sauer (pH < 1) |
Sicherheit und Gefahren von Chromsäure
Chromsäure birgt mehrere Sicherheitsrisiken und sollte mit Vorsicht gehandhabt werden. Es handelt sich um eine ätzende Substanz, die bei Kontakt schwere Verätzungen der Haut, der Augen und der Atemwege verursachen kann. Das Einatmen von Chromsäuredämpfen oder -nebeln kann die Atemwege reizen und Husten, Kurzatmigkeit und Lungenschäden verursachen. Außerdem ist es bei Einnahme sehr giftig und verursacht Bauchschmerzen, Erbrechen und potenzielle Organschäden. Darüber hinaus ist Chromsäure ein starkes Oxidationsmittel und kann heftig reagieren oder brennbare Stoffe entzünden. Bei der Arbeit mit Chromsäure sollte entsprechende Schutzausrüstung wie Handschuhe, Schutzbrille und Laborkittel getragen werden und diese gemäß den Sicherheitsvorschriften gelagert und entsorgt werden.
| Gefahrensymbole | Ätzend, oxidierend |
| Sicherheitsbeschreibung | – Verursacht schwere Verbrennungen – Kann einen Intensivbrand verursachen; Oxidationsmittel – Gesundheitsschädlich beim Verschlucken – Verursacht Reizungen der Atemwege – Verursacht Augenschäden – Kann genetische Defekte verursachen – Kann Krebs verursachen – Kann die Fruchtbarkeit oder das ungeborene Kind schädigen – Sehr giftig für Wasserorganismen – Korrekt handhaben und entsorgen |
| UN-Identifikationsnummern | UN1755, UN1463 |
| HS-Code | 28191000 |
| Gefahrenklasse | 8 (ätzend) |
| Verpackungsgruppe | II (Mittelstufe) |
| Toxizität | Sehr giftig und schädlich |
Methoden zur Synthese von Chromsäure
Es gibt verschiedene Methoden zur Synthese von Chromsäure.
Eine übliche Methode beinhaltet die Reaktion zwischen Natriumdichromat (Na2Cr2O7) und Schwefelsäure (H2SO4) . Bei diesem Verfahren gibt man unter Rühren langsam Natriumdichromat zur Schwefelsäure hinzu. Die Reaktion verläuft unter Bildung von Chromsäure (H2CrO4) und Natriumsulfat (Na2SO4) als Nebenprodukt. Die resultierende Chromsäurelösung kann durch Entfernen von überschüssigem Wasser gereinigt und konzentriert werden.
Ähnlich wie bei der vorherigen Methode können wir der Schwefelsäure Kaliumchromat hinzufügen, was zur Bildung von Chromsäure und Kaliumsulfat (K2SO4) als Nebenprodukt führt.
Alternativ können Sie Chromsäure herstellen, indem Sie Chromtrioxid (CrO3) mit Wasser reagieren lassen. Sie lösen Chromtrioxid in Wasser auf, wodurch eine Chromsäurelösung entsteht.
Bedenken Sie, dass Chromsäure ein stark ätzender und gefährlicher Stoff ist. Daher sollte seine Synthese unter entsprechenden Sicherheitsvorkehrungen und in einem gut belüfteten Bereich durchgeführt werden. Tragen Sie während des Syntheseprozesses Schutzausrüstung wie Handschuhe, Schutzbrille und einen Laborkittel. Befolgen Sie außerdem die richtigen Entsorgungsmethoden, um die sichere Handhabung und Entsorgung aller bei der Synthese entstehenden Abfälle zu gewährleisten.
Verwendung von Chromsäure
Chromsäure findet aufgrund ihrer Eigenschaften als starkes Oxidationsmittel vielfältige Anwendungsmöglichkeiten. Hier sind einige häufige Verwendungszwecke:
- Metallreinigung: Chromsäure entfernt effektiv Rost, Zunder und organische Ablagerungen von Metalloberflächen und reinigt und entfernt Oberflächenverunreinigungen.
- Ätzen: Chromsäure erzeugt feine Muster und Designs auf Oberflächen wie Glas, Keramik und Metallen, ätzt sie und macht sie für die Herstellung dekorativer Glaswaren und die Herstellung elektronischer Schaltkreise nützlich.
- Oberflächenvorbereitung: Bei industriellen Prozessen werden Oberflächen mit Chromsäure zum Lackieren, Beschichten oder Kleben vorbereitet. Dabei wird eine gute Haftung durch Entfernen von Verunreinigungen gewährleistet und eine saubere Oberfläche geschaffen.
- Analytische Chemie: Chemiker und Labore verwenden Chromsäure als Oxidationsmittel in chemischen Analysen und Laborexperimenten und bestimmen die Konzentrationen bestimmter organischer Verbindungen.
- Holzschutz: Chromsäure wirkt als Holzschutzmittel und dringt tief in die Holzfasern ein, um es vor Fäulnis, Insektenbefall und Witterungseinflüssen zu schützen.
- Textilindustrie: Die Textilindustrie verwendet Chromsäure für Färbe- und Druckprozesse, zur Fixierung von Farbstoffen in Stoffen und zur Verbesserung der Farbechtheit.
- Fotografie: Chromsäure spielt bei bestimmten fotografischen Prozessen eine Rolle, darunter bei der Herstellung von Farbdrucken und Farbumkehrfilmen.
- Galvanisieren: Bei galvanischen Verfahren, insbesondere beim Verchromen, dient Chromsäure als Quelle für Chromionen, die sich auf Metalloberflächen ablagern und so für eine schützende und dekorative Beschichtung sorgen.
Es ist wichtig zu beachten, dass Chromsäure ein gefährlicher Stoff ist und bei der Handhabung, Lagerung und Entsorgung entsprechende Sicherheitsvorkehrungen getroffen werden sollten.
Fragen:
F: Was passiert, wenn Phenol mit Chromsäure oxidiert wird?
A: Phenol wird mit Chromsäure oxidiert, was zur Bildung von Chinonen und Wasser führt.
F: Wie bereitet man Chromsäure zu?
A: Chromsäure kann durch Reaktion von Natriumdichromat oder Kaliumchromat mit Schwefelsäure hergestellt werden.
F: Wie stellt man Chromsäure her?
A: Chromsäure kann durch Mischen einer Chromverbindung (z. B. Chromtrioxid) mit Wasser hergestellt werden.
F: Was ist Chromsäure?
A: Chromsäure ist ein starkes und ätzendes Oxidationsmittel, das aus Chrom, Wasserstoff und Sauerstoff besteht.
F: Reduziert Chromsäure Alkene?
A: Nein, Chromsäure ist ein Oxidationsmittel und hat keine reduzierenden Eigenschaften.
F: Wie bereitet man Chromsäure zur Reinigung von Laborglas vor?
A: Eine Chromsäure-Reinigungslösung kann durch Auflösen von Chromtrioxid in Wasser und Zugabe von Schwefelsäure hergestellt werden.
F: Ist Chromsäure eine starke Säure?
A: Ja, Chromsäure gilt aufgrund ihrer Fähigkeit, Protonen abzugeben, als starke Säure.
F: Wie bereite ich eine Chromsäure-Reinigungslösung vor?
A: Um eine Chromsäure-Reinigungslösung herzustellen, lösen Sie Chromtrioxid in Wasser und geben Sie eine kleine Menge Schwefelsäure hinzu.
F: Welcher der folgenden Alkohole führt zu einem positiven Chromsäuretest?
A: Primäre Alkohole können einen positiven Chromsäuretest ergeben und einen Farbumschlag von Orange nach Grün oder Blau hervorrufen.
