Chloressigsäure ist eine chemische Verbindung mit der Formel CH₂ClCOOH. Es wird in verschiedenen industriellen Anwendungen eingesetzt, darunter bei der Herstellung von Farbstoffen, Pharmazeutika und Herbiziden.
| IUPAC-Name | Chloressigsäure |
| Molekularformel | CH₂ClCOOH |
| CAS-Nummer | 79-11-8 |
| Synonyme | Monochloressigsäure, MCA, Chlorethansäure, Chlorethylsäure |
| InChI | InChI=1S/C2H3ClO2/c3-1-2(4)5/h1H2,(H,4,5) |
Eigenschaften von Chloressigsäure
Chloressigsäure-Formel
Die Formel für Chloressigsäure lautet CH₂ClCOOH. Es besteht aus zwei Kohlenstoffatomen, drei Wasserstoffatomen, einem Chloratom und zwei Sauerstoffatomen. Das Chloratom ist an eines der Kohlenstoffatome gebunden, während das andere Kohlenstoffatom an die Carbonsäuregruppe (-COOH) gebunden ist.
Molmasse von Chloressigsäure
Die Molmasse von Monochloressigsäure wird durch Addition der Atommassen ihrer Bestandteile berechnet. Monochloressigsäure hat eine Molmasse von etwa 94,5 Gramm pro Mol. Sie wird durch Berücksichtigung der in der Verbindung vorhandenen Atommassen von Kohlenstoff (C), Wasserstoff (H), Chlor (Cl) und Sauerstoff (O) bestimmt.
Siedepunkt von Chloressigsäure
Monochloressigsäure hat einen Siedepunkt von etwa 189 Grad Celsius. Bei dieser Temperatur geht flüssige Monochloressigsäure in die Gasphase über. Der Siedepunkt der Monochloressigsäure wird durch intermolekulare Kräfte zwischen ihren Molekülen und den Atmosphärendruck beeinflusst.
Chloressigsäure Schmelzpunkt
Der Schmelzpunkt von Monochloressigsäure liegt bei etwa 62 Grad Celsius. Dies ist die Temperatur, bei der die feste Form der Monochloressigsäure in den flüssigen Zustand übergeht. Der Schmelzpunkt kann je nach Reinheit der Probe und den Bedingungen, unter denen sie gemessen wird, leicht variieren.
Dichte von Chloressigsäure g/ml
Die Dichte von Monochloressigsäure beträgt etwa 1,58 Gramm pro Milliliter. Sie gibt die Masse an Monochloressigsäure pro Volumeneinheit an. Die Dichte von Monochloressigsäure wird durch Faktoren wie Temperatur und Druck beeinflusst.
Molekulargewicht der Chloressigsäure
Das Molekulargewicht von Monochloressigsäure beträgt etwa 94,5 Gramm pro Mol. Es stellt die Summe der Atomgewichte aller Atome in einem Molekül Monochloressigsäure dar. Das Molekulargewicht ist bei verschiedenen Berechnungen der Verbindung hilfreich, beispielsweise bei der Bestimmung von Konzentrationen oder Molmengen.
Struktur von Chloressigsäure
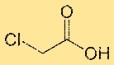
Monochloressigsäure hat eine Struktur, die aus einem zentralen Kohlenstoffatom, das an ein Chloratom gebunden ist, einer Carbonsäuregruppe (-COOH) und zwei Wasserstoffatomen besteht. Das Chloratom ist direkt an das Kohlenstoffatom gebunden. Die strukturelle Anordnung der Monochloressigsäure beeinflusst ihre chemischen Eigenschaften und Reaktivität.
Löslichkeit von Chloressigsäure
Monochloressigsäure ist in Wasser mäßig löslich. Es bildet Wasserstoffbrückenbindungen mit Wassermolekülen, wodurch es sich bis zu einem gewissen Grad auflösen kann. Die Löslichkeit von Monochloressigsäure wird durch Faktoren wie Temperatur, pH-Wert und das Vorhandensein anderer Substanzen in der Lösung beeinflusst.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 1,58 g/ml |
| Farbe | Farblos |
| Geruch | Essig |
| Molmasse | 94,5 g/Mol |
| Dichte | 1,58 g/ml |
| Fusionspunkt | 62°C |
| Siedepunkt | 189°C |
| Blitzpunkt | 111°C |
| Löslichkeit in Wasser | Mischbar |
| Löslichkeit | Löslich in Ethanol, Ether, Chloroform |
| Dampfdruck | 0,23 mmHg bei 25°C |
| Wasserdampfdichte | 3,3 (Luft = 1) |
| pKa | 2,87 |
| pH-Wert | 1,5 – 2,5 |
Sicherheit und Gefahren von Chloressigsäure
Monochloressigsäure birgt mehrere Sicherheitsrisiken und sollte mit Vorsicht gehandhabt werden. Es wirkt ätzend auf Haut, Augen und Atemwege und verursacht Verbrennungen und Reizungen. Direkter Kontakt kann schwere Haut- und Augenschäden verursachen. Das Einatmen der Dämpfe oder Nebel kann zu Reizungen der Atemwege führen. Es ist außerdem schädlich, wenn es verschluckt wird und zu Magen-Darm-Beschwerden führt. Bei der Arbeit mit Monochloressigsäure sollte geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden. Eine ausreichende Belüftung ist entscheidend, um die Exposition zu minimieren. Bei Haut- oder Augenkontakt ist eine sofortige Spülung mit Wasser unbedingt erforderlich und es sollte ein Arzt aufgesucht werden.
| Gefahrensymbole | Ätzend, giftig |
| Sicherheitsbeschreibung | Kontakt vermeiden. Persönliche Schutzausrüstung verwenden. Sorgen Sie für ausreichende Belüftung. Mit Vorsicht behandeln. |
| UN-Identifikationsnummern | UN 1751 |
| HS-Code | 2915.12.00 |
| Gefahrenklasse | 8 (ätzend) |
| Verpackungsgruppe | II |
| Toxizität | Giftig beim Verschlucken, Einatmen und Hautabsorption. Verursacht schwere Verbrennungen und Augenschäden. Gesundheitsschädlich beim Verschlucken. |
Methoden zur Synthese von Chloressigsäure
Verschiedene Methoden ermöglichen die Synthese von Monochloressigsäure.
Eine häufig verwendete Methode zur Synthese von Monochloressigsäure umfasst die Behandlung von Essigsäure mit einem Halogenierungsmittel, üblicherweise Chlorgas (Cl₂), in Gegenwart eines Katalysators wie Schwefelsäure (H₂SO₄). Die Reaktion zwischen Essigsäure und Chlor führt zur Substitution eines Wasserstoffatoms im Essigsäuremolekül durch ein Chloratom, wodurch Monochloressigsäure entsteht.
Eine andere Methode beinhaltet die Reaktion zwischen Acetylchlorid (CH₃COCl) und Wasser (H₂O). Wasser hydrolysiert Acetylchlorid, was zur Bildung von Monochloressigsäure führt. Diese Reaktion ist exotherm und erfordert Vorsicht bei der Durchführung.
Die Bildung von Monochloressigsäure erfolgt durch Carboxylierung von Chlormethan (CH₃Cl) mit Kohlendioxid (CO₂) in Gegenwart einer robusten Base wie Natriumhydroxid (NaOH) . Die Reaktion verläuft durch nukleophile Substitution, wobei die Carboxylatgruppe (-COOH) des Kohlendioxidmoleküls das Chloridion ersetzt.
Bedenken Sie, dass die richtige Handhabung und Sicherheitsvorkehrungen für diese Synthesemethoden aufgrund der ätzenden und toxischen Natur von Monochloressigsäure von entscheidender Bedeutung sind. Sorgen Sie für eine sorgfältige Kontrolle der Reaktionsbedingungen und eine ordnungsgemäße Entsorgung von Nebenprodukten und Abfällen, um sichere und effiziente Syntheseprozesse zu gewährleisten.
Verwendung von Chloressigsäure
Aufgrund seiner vielseitigen Eigenschaften findet Monochloressigsäure in verschiedenen Branchen Anwendung. Hier sind einige häufige Verwendungszwecke:
- Herbizidproduktion: Monochloressigsäure ist ein wesentlicher Bestandteil bei der Synthese von Herbiziden wie Glyphosat. Es hilft, das Wachstum unerwünschter Pflanzen und Unkräuter in der Landwirtschaft zu hemmen.
- Pharmazeutische Herstellung: Es dient als Baustein bei der Herstellung pharmazeutischer Verbindungen, einschließlich Antibiotika, Antiseptika und Analgetika. Monochloressigsäure trägt dazu bei, die gewünschten Eigenschaften dieser Arzneimittel zu modifizieren und zu verbessern.
- Farbstoff- und Pigmentindustrie: Hersteller verwenden Monochloressigsäure bei der Herstellung von Farbstoffen und Pigmenten. Es hilft bei der Synthese von Farbstoffen, die in Textilien, Farben, Tinten und anderen dekorativen Anwendungen verwendet werden.
- Chemische Zwischenprodukte: Es fungiert als wichtige Zwischenverbindung bei der Herstellung verschiedener Chemikalien. Bei der Synthese von Polymeren, Lösungsmitteln, Weichmachern und anderen organischen Verbindungen werden diese Zwischenprodukte verwendet.
- Herstellung von Tensiden: Monochloressigsäure spielt eine Rolle bei der Herstellung von Tensiden, die wesentliche Bestandteile von Waschmitteln, Reinigungsmitteln und Körperpflegeprodukten sind. Tenside tragen dazu bei, die Oberflächenspannung zwischen Flüssigkeiten zu verringern und ermöglichen so eine bessere Misch- und Dispergierfähigkeit.
- Forschungs- und Laboranwendungen: Forschungslabore verwenden Monochloressigsäure als Reagenz für chemische Reaktionen, insbesondere bei organischen Synthesen und Analyseverfahren.
- Chemische Reaktionen und organische Synthese: Es dient als wichtiges Reagens bei verschiedenen organischen Reaktionen, wie z. B. nukleophilen Substitutionen, Veresterungen und Carboxylierungsreaktionen.
- Galvanisieren: Monochloressigsäure findet Anwendung in Galvanisierungsprozessen, wo sie als Chlorquelle für die Abscheidung von Metallbeschichtungen auf Oberflächen fungiert.
Diese vielfältigen Anwendungen unterstreichen die Bedeutung von Monochloressigsäure in allen Branchen und tragen zur Entwicklung zahlreicher chemischer Produkte und Prozesse bei.
Fragen:
F: Wie hoch ist der Ka-Wert für eine 0,15 M Chloressigsäurelösung mit einem pH-Wert von 1,86?
A: Der Ka-Wert von Monochloressigsäure kann anhand des pH-Werts berechnet werden und beträgt etwa 1,4 x 10^-3.
F: Ist Chloressigsäure stark oder schwach?
A: Monochloressigsäure ist eine schwache Säure.
F: Was ergibt Natrium-4-chlorphenolat + Chloressigsäure?
A: Die Reaktion von Natrium-4-chlorphenolat mit Monochloressigsäure ergibt 4-Chlorphenoxyessigsäure und Natriumchlorid.
F: Wie groß ist der Ka von Chloressigsäure?
A: Der Ka-Wert von Monochloressigsäure beträgt etwa 1,4 x 10^-3.
F: Ist Chloressigsäure monoprotisch?
A: Ja, Monochloressigsäure ist monoprotisch, das heißt, sie kann bei einer chemischen Reaktion nur ein Proton (H+-Ion) abgeben.
F: Wie groß ist die Ionisationskonstante von Chloressigsäure?
A: Die Ionisationskonstante (Ka) von Monochloressigsäure beträgt etwa 1,4 x 10^-3.
F: Ist Chloressigsäure stärker als Essigsäure?
A: Ja, Monochloressigsäure ist stärker als Essigsäure.
F: Warum ist Chloressigsäure stärker als Essigsäure?
A: Das Vorhandensein des Chloratoms in Monochloressigsäure erhöht ihre Elektronenanziehungskapazität und macht sie saurer als Essigsäure.
F: Wie groß ist die Molmasse von Chloressigsäure?
A: Die Molmasse von Monochloressigsäure beträgt etwa 94,5 Gramm pro Mol.
