Fluormethan (CH3F) ist ein farbloses Gas mit leicht ätherischem Geruch. Es wird in der Elektronik- und Arzneimittelproduktion sowie als Kältemittel eingesetzt. Es ist nicht sehr giftig, stellt aber ein starkes Treibhausgas dar.
| IUPAC-Name | Fluormethan |
| Molekularformel | CH3F |
| CAS-Nummer | 593-53-3 |
| Synonyme | Methylfluorid, Freon 41, Halocarbon 41, R 41, UN 2452 |
| InChI | InChI=1S/CH3F/c1-2/h1H3 |
Eigenschaften von Fluormethan
CH3F Siedepunkt
Der Siedepunkt von CH3F liegt bei -78,4°C, was relativ niedrig ist. Dies macht es zu einem idealen Kältemittel für verschiedene Anwendungen wie Kühl- und Klimaanlagen. CH3F wird aufgrund seines niedrigen Siedepunkts auch als Treibmittel in Aerosolen verwendet.
CH3F Molmasse
CH3F ist eine chemische Verbindung mit der Summenformel CH3F. Es ist auch als Methylfluorid bekannt und hat eine Molmasse von 34,03 g/mol. CH3F ist ein farbloses Gas mit leicht ätherischem Geruch und wird aufgrund seiner einzigartigen Eigenschaften häufig in verschiedenen Anwendungen eingesetzt.
CH3F Schmelzpunkt
CH3F hat einen Schmelzpunkt von -141 °C, was ebenfalls relativ niedrig ist. Sein niedriger Schmelzpunkt erleichtert die Handhabung und den Transport und macht es zu einer beliebten Wahl für verschiedene industrielle Anwendungen. Der niedrige Schmelzpunkt von CH3F macht es auch für den Einsatz als Kältemittel in Tieftemperaturanwendungen geeignet.
Dichte CH3F
Die Dichte von CH3F beträgt 0,89 g/ml, was relativ niedrig ist. Dadurch ist es weniger dicht als Luft, die eine Dichte von 1,29 g/ml hat. Daher wird CH3F häufig als Gas, das leichter als Luft ist, in verschiedenen Anwendungen verwendet, darunter Lecksuche, Gaschromatographie und als Traggas für Ballons und Luftschiffe.
CH3F-Molekulargewicht
Das Molekulargewicht von CH3F beträgt 34,03 g/mol, was relativ niedrig ist. Dies macht es zu einem leichten Compound, das einfach zu handhaben und zu transportieren ist. CH3F wird aufgrund seines niedrigen Molekulargewichts und seiner einzigartigen Eigenschaften häufig in der Produktion von Elektronik- und Pharmazeutika verwendet.
Struktur von CH3F
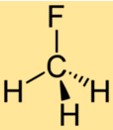
Die Struktur von CH3F besteht aus einem einzelnen Kohlenstoffatom, das an drei Wasserstoffatome und ein Fluoratom gebunden ist. Das Fluoratom ist an das Kohlenstoffatom gebunden und ersetzt eines der Wasserstoffatome im Methan. Die Struktur von CH3F macht es zu einer stabilen Verbindung mit einzigartigen chemischen Eigenschaften.
Fluormethan-Formel
Die Formel für Fluormethan lautet CH3F, was die Anordnung der Atome im Molekül darstellt. Die Formel zeigt, dass Fluormethan aus einem Kohlenstoffatom, drei Wasserstoffatomen und einem Fluoratom besteht. Die Formel wird zur Beschreibung der chemischen Zusammensetzung von Fluormethan verwendet und ist für verschiedene Anwendungen wichtig.
| Aussehen | Farbloses Gas |
| Spezifisches Gewicht | 0,89 bei 20°C (Luft = 1) |
| Farbe | Farblos |
| Geruch | Leicht ätherischer Geruch |
| Molmasse | 34,03 g/Mol |
| Dichte | 0,89 g/ml |
| Fusionspunkt | -141°C |
| Siedepunkt | -78,4°C |
| Blitzpunkt | Nicht brennbar |
| Löslichkeit in Wasser | 0,5 g/L bei 20°C |
| Löslichkeit | Mit organischen Lösungsmitteln mischbar |
| Dampfdruck | 4,4 bar bei 20°C |
| Wasserdampfdichte | 1,43 (Luft = 1) |
| pKa | 50.9 |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Fluormethan
Fluormethan gilt im Allgemeinen als sicher zu handhaben und zu verwenden, weist eine geringe Toxizität auf und ist nicht brennbar. Allerdings birgt es, wie jede Chemikalie, potenzielle Gefahren und Sicherheitsaspekte. Die Einwirkung hoher Fluormethankonzentrationen kann Schwindel, Kopfschmerzen und Übelkeit verursachen. Es ist auch ein starkes Treibhausgas, das zum Klimawandel beiträgt. Fluormethan sollte in einem gut belüfteten Bereich gehandhabt werden und Schutzausrüstung wie Handschuhe und Schutzbrillen getragen werden. Es ist wichtig, ordnungsgemäße Lagerungs- und Handhabungsverfahren einzuhalten, um Leckagen und versehentliche Freisetzungen in die Umwelt zu vermeiden.
| Gefahrensymbole | F+ |
| Sicherheitsbeschreibung | Leicht entzündliches Gas; Giftig beim Einatmen; Verursacht Hautreizungen; Verursacht schwere Augenreizung; Kann Schläfrigkeit oder Schwindelgefühl verursachen; Kann Organschäden verursachen |
| AN-Kennungen | UN2452 |
| HS-Code | 2903.49.90 |
| Gefahrenklasse | 2.1 |
| Verpackungsgruppe | II |
| Toxizität | Geringe Toxizität, kann jedoch bei Einatmen hoher Konzentrationen gesundheitliche Auswirkungen haben. |
Methoden zur Fluormethan-Synthese
Mehrere Methoden, einschließlich direkter Methanfluorierung und Halogenaustauschreaktionen, können Fluormethan synthetisieren.
Eine übliche Methode ist die Reaktion von Methanol mit Fluorwasserstoff in Gegenwart eines Katalysators wie Aluminiumoxid oder Aluminiumfluorid.
Eine andere Methode beinhaltet die Reaktion von Chlormethan oder Brommethan mit Fluorwasserstoffgas. Bei beiden Methoden entsteht Fluormethan als Nebenprodukt, das dann durch Destillation oder andere Methoden abgetrennt und gereinigt werden kann.
Eine andere Methode zur Synthese von Fluormethan umfasst die Reaktion von Fluoroform und Chlorwasserstoff in Gegenwart eines Katalysators wie Zink oder Kupfer. Bei dieser Reaktion entsteht ein Gemisch aus Chlorfluormethan und Fluormethan, das durch Destillation getrennt und gereinigt werden kann.
Verwendung von Fluormethan
Fluormethan wird in verschiedenen Branchen vielfältig eingesetzt, darunter:
- Kühlung: Wird aufgrund seines niedrigen Siedepunkts und seiner Nichtentflammbarkeit als Kältemittel in industriellen und gewerblichen Kühlsystemen verwendet.
- Elektronik: Wird als Reinigungsmittel für elektronische Komponenten und als Plasmaätzmittel in der Halbleiterindustrie verwendet.
- Medizinische Anwendungen: Wird aufgrund seiner geringen Toxizität und schnellen Wirkung als Anästhetikum in der Veterinärmedizin verwendet.
- Pestizidproduktion: Wird als Vorstufe bei der Herstellung bestimmter Pestizide, einschließlich Herbiziden und Insektiziden, verwendet.
- Polymerherstellung: Wird als Treibmittel bei der Herstellung von Polymerschäumen wie Polyurethanschaum verwendet.
- Laboranwendungen: Wird als Lösungsmittel und Reagenz in verschiedenen Laboranwendungen verwendet, einschließlich chemischer Synthese und Analyse.
- Feuerunterdrückung: Wird auch als Feuerlöschmittel in bestimmten Arten von Feuerlöschern verwendet, insbesondere in solchen, die in Computer- und Telekommunikationsräumen verwendet werden.
Fragen:
F: Ist CH3F polar oder unpolar?
A: CH3F ist aufgrund der asymmetrischen Anordnung von Fluor- und Wasserstoffatomen um das zentrale Kohlenstoffatom ein polares Molekül, was zu einem Nettodipolmoment führt.
F: Hat CH3F eine Wasserstoffbindung?
A: Fluormethan weist keine Wasserstoffbindung auf, da es kein Wasserstoffatom enthält, das an ein stark elektronegatives Element wie Stickstoff, Sauerstoff oder Fluor gebunden ist.
F: Welche Verbindung hat die stärksten intermolekularen Kräfte: HF, CH3Cl, CH3F, HCl?
A: HF hat aufgrund seiner Fähigkeit, Wasserstoffbrückenbindungen zu bilden, die stärksten intermolekularen Kräfte, die stärker sind als die Dipol-Dipol-Kräfte anderer Verbindungen.
F: Welches hat die schwächsten Dipol-Dipol-Kräfte: N2, CO, CH3F, HCl?
A: N2 hat die geringsten Dipol-Dipol-Kräfte, weil es ein unpolares Molekül ist und daher kein Netto-Dipolmoment hat. CO, CH3F und HCl sind polare Moleküle und haben Dipol-Dipol-Kräfte, aber die Stärke dieser Kräfte nimmt aufgrund der zunehmenden Polarität der Moleküle in der Reihenfolge HCl < CH3F < CO zu.
