Dichlormethan (CH2Cl2) oder Methylenchlorid löst eine Vielzahl organischer Verbindungen und wird häufig als Lösungsmittel in chemischen Labors verwendet. Es kann auch zum Entlacken und Entfetten verwendet werden.
| IUPAC-Name | Dichlormethan |
| Molekularformel | CH2Cl2 |
| CAS-Nummer | 75-09-2 |
| Synonyme | Methylenchlorid, Methylendichlorid, DCM, Narkotil, Solaesthin, Solmethin usw. |
| InChI | InChI=1S/CH2Cl2/c2-1-3/h1H2 |
Dichlormethan Dichte g/ml
Die Dichte von Dichlormethan beträgt 1,326 g/ml. Dieser Wert gibt die Masse an Dichlormethan pro Volumeneinheit bei einer bestimmten Temperatur und einem bestimmten Druck an. Die Dichte von Dichlormethan ist relativ hoch und daher eine dichtere Flüssigkeit als Wasser. Diese Eigenschaft macht es in einigen Laboranwendungen nützlich, wo es zur Trennung von Substanzen unterschiedlicher Dichte verwendet werden kann.
Siedepunkt von Dichlormethan
Der Siedepunkt von Dichlormethan beträgt 39,6 °C (103,3 °F). Diese Temperatur gibt den Punkt an, an dem die flüssige Form von Dichlormethan in seinen gasförmigen Zustand übergeht. Der niedrige Siedepunkt von Dichlormethan macht es zu einer sehr flüchtigen Verbindung, die bei Raumtemperatur leicht verdampfen kann. Diese Eigenschaft macht es als Lösungsmittel in vielen Laboranwendungen nützlich, wo es leicht verdampft werden kann.
Molmasse von Dichlormethan
Die Molmasse von Dichlormethan, auch Methylenchlorid genannt, beträgt 84,93 g/mol. Dieser Wert ergibt sich aus der Addition der Atommassen der Atome eines einzelnen Dichlormethanmoleküls. Die Summenformel für Dichlormethan lautet CH2Cl2, was bedeutet, dass es ein Kohlenstoffatom, zwei Wasserstoffatome und zwei Chloratome enthält. Die Molmasse ist eine wichtige Eigenschaft zur Bestimmung der Menge einer Substanz, die in einer bestimmten Probe vorhanden ist.
Schmelzpunkt von Dichlormethan
Der Schmelzpunkt von CH2Cl2 beträgt -97,4 °C (-143,3 °F). Diese Temperatur gibt den Punkt an, an dem die feste Form von CH2Cl2 in seinen flüssigen Zustand übergeht. Allerdings kommt CH2Cl2 selten in fester Form vor, da es bei Raumtemperatur eine flüchtige Flüssigkeit ist. Der niedrige Schmelzpunkt von CH2Cl2 erschwert das Einfrieren und es bleibt auch bei niedrigen Temperaturen flüssig.
Molekulargewicht von Dichlormethan
Das Molekulargewicht von CH2Cl2 beträgt 84,93 g/mol. Dieser Wert ist die Summe der Atomgewichte der Atome eines einzelnen CH2Cl2-Moleküls. Das Molekulargewicht ist eine wichtige Eigenschaft zur Bestimmung der Menge einer Substanz in einer bestimmten Probe.
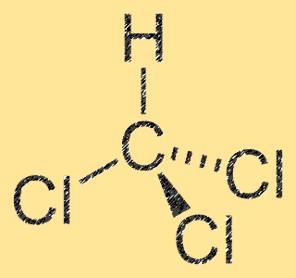
Struktur von Dichlormethan
CH2Cl2 hat eine tetraedrische Molekülstruktur mit einem zentralen Kohlenstoffatom, das an zwei Chloratome und zwei Wasserstoffatome gebunden ist. Das Molekül besitzt ein Dipolmoment, das aus dem Elektronegativitätsunterschied zwischen den Kohlenstoff- und Chloratomen resultiert. Das Kohlenstoffatom ist teilweise positiv geladen, während die Chloratome teilweise negativ geladen sind. Diese Eigenschaft macht CH2Cl2 zu einem polaren Molekül.
Dichlormethan-Formel
Die Summenformel für Dichlormethan lautet CH2Cl2. Die Formel besagt, dass das Molekül ein Kohlenstoffatom, zwei Wasserstoffatome und zwei Chloratome enthält. Die Formel gibt auch Auskunft über die relative Anzahl der Atome in einem einzelnen Dichlormethanmolekül. Die Formel eignet sich zur Bestimmung der Stöchiometrie chemischer Reaktionen mit Dichlormethan.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 1.326 |
| Farbe | Farblos |
| Geruch | Milder Geruch, ähnlich wie Chloroform |
| Molmasse | 84,93 g/Mol |
| Dichte | 1.326 g/ml |
| Fusionspunkt | -97,4°C (-143,3°F) |
| Siedepunkt | 39,6°C (103,3°F) |
| Blitzpunkt | -22°C (-8°F) |
| Löslichkeit in Wasser | 16,5 g/L bei 20 °C (68 °F) |
| Löslichkeit | Mit vielen organischen Lösungsmitteln mischbar |
| Dampfdruck | 44,6 kPa bei 20 °C (68 °F) |
| Wasserdampfdichte | 2,93 |
| pKa | 4 |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Dichlormethan
Dichlormethan (CH2Cl2), auch bekannt als Methylenchlorid, ist eine gefährliche Chemikalie, die bei unsachgemäßer Handhabung erhebliche Sicherheitsrisiken birgt. Es ist leicht entzündlich und kann bei Einwirkung von Hitze oder offenen Flammen Brände oder Explosionen verursachen. Das Einatmen seiner Dämpfe kann zu Reizungen der Atemwege, Kopfschmerzen, Schwindel und sogar Bewusstlosigkeit führen. Hautkontakt mit CH2Cl2 kann zu Reizungen, Verbrennungen oder Verätzungen führen. Es ist außerdem potenziell krebserregend, da eine langfristige Exposition das Risiko für Leber- und Lungenkrebs erhöht. Bei der Arbeit mit CH2Cl2 sind angemessene Sicherheitsvorkehrungen wie die Verwendung geeigneter persönlicher Schutzausrüstung und das Arbeiten in einem gut belüfteten Bereich unerlässlich.
| Gefahrensymbole | Xn,F |
| Sicherheitsbeschreibung | Leicht entzündliche Flüssigkeit und Dampf. Gesundheitsschädlich bei Verschlucken, Einatmen oder Aufnahme durch die Haut. Verursacht Hautreizungen und schwere Augenreizungen. Kann Reizungen der Atemwege verursachen. Kann Schläfrigkeit oder Schwindelgefühl verursachen. Kann bei Verschlucken und Eindringen in die Atemwege tödlich sein. |
| AN-Kennungen | UN 1593 |
| HS-Code | 29031200 |
| Gefahrenklasse | 3 |
| Verpackungsgruppe | II |
| Toxizität | Dichlormethan gilt als Karzinogen der Kategorie 2 und wird mit Leber- und Lungenkrebs in Verbindung gebracht. Es ist auch bekannt, dass es eine Depression des Zentralnervensystems verursacht und bei Einnahme oder Einatmen in hohen Konzentrationen tödlich sein kann. Bei der Arbeit mit Dichlormethan sollten stets entsprechende Sicherheitsvorkehrungen getroffen werden. |
Dichlormethan-Synthesemethoden
Es gibt verschiedene Methoden zur Synthese von Dichlormethan (CH2Cl2), einer farblosen Flüssigkeit, die als Lösungsmittel und Abbeizmittel verwendet wird. Eine übliche Methode beinhaltet die Reaktion von Methangas mit Chlorgas in Gegenwart eines Katalysators, üblicherweise Aluminiumchlorid oder Eisenchlorid. Bei der Reaktion entstehen als Nebenprodukte sowohl CH2Cl2 als auch Chlorwasserstoffgas. Eine andere Methode beinhaltet die Chlorierung von Methanol mit Chlorwasserstoffgas oder Thionylchlorid. Bei dieser Reaktion entstehen ebenfalls CH2Cl2 als Produkt sowie Wasser oder Schwefeldioxid als Nebenprodukte.
Eine andere Methode beinhaltet die Reaktion von Chloroform mit Zink in Gegenwart von Salzsäure. Bei dieser Reaktion entstehen sowohl CH2Cl2 als auch Zinkchlorid als Produkte, wobei Wasserstoffgas als Nebenprodukt entsteht.
Bei der Chlorierung verschiedener organischer Verbindungen wie Ethan oder Propan in Gegenwart eines Katalysators kann CH2Cl2 als Nebenprodukt entstehen.
Unabhängig von der verwendeten Methode ist es aufgrund seiner gefährlichen Eigenschaften wichtig, mit CH2Cl2 vorsichtig umzugehen. Bei der Synthese und Handhabung von CH2Cl2 ist es wichtig, entsprechende Sicherheitsvorkehrungen zu treffen, wie z. B. das Tragen geeigneter persönlicher Schutzausrüstung und das Arbeiten in einem gut belüfteten Bereich.
Verwendung von Dichlormethan
Dichlormethan, auch Methylenchlorid genannt, findet als vielseitiges organisches Lösungsmittel zahlreiche Anwendungen in Industrie und Forschung. Es spielt eine entscheidende Rolle bei der Herstellung von Arzneimitteln und Beschichtungen wie Farben und Lacken. Darüber hinaus ist es ein nützliches Reinigungsmittel zum Entfetten in der Elektronikfertigung und Metallurgie.
Dichlormethan löst und entfernt viele Arten von Farben und Beschichtungen und ist daher ein beliebtes Abbeizmittel. Bemerkenswert ist auch die Verwendung als Treibmittel bei der Herstellung von Polyurethanschäumen, Polycarbonatharzen und anderen Kunststoffen.
Neben seiner industriellen Verwendung ist Dichlormethan auch bei der Gewinnung von Naturprodukten wie ätherischen Ölen und Parfümen aus Pflanzenmaterialien wertvoll. Es ist auch ein wirksames Lösungsmittel für viele organische Verbindungen, die in Laborreagenzien in der organischen Synthese verwendet werden.
Aufgrund seiner gefährlichen Eigenschaften wie Entflammbarkeit und Toxizität erfordert Dichlormethan jedoch einen sorgfältigen Umgang. Es ist wichtig, angemessene Sicherheitsvorkehrungen zu treffen, einschließlich der Arbeit in einem gut belüfteten Bereich und dem Tragen geeigneter persönlicher Schutzausrüstung bei der Arbeit mit Dichlormethan.
Fragen:
F: Ist Dichlormethan polar?
A: Ja, Dichlormethan ist ein polares Lösungsmittel.
F: Welche der folgenden Risiken sind mit Dichlormethan verbunden?
A: Zu den mit Dichlormethan verbundenen Gefahren gehören seine Entflammbarkeit, Toxizität und das Potenzial für Haut- und Atemwegsreizungen.
F: Ist Dichlormethan brennbar?
A: Ja, Dichlormethan ist brennbar und kann Brände oder Explosionen verursachen, wenn es Hitze oder offenen Flammen ausgesetzt wird.
F: Ist Dichlormethan wasserlöslich?
A: Ja, Dichlormethan ist in Wasser schwer löslich. Es wird jedoch hauptsächlich als Lösungsmittel für unpolare Verbindungen verwendet und wird üblicherweise nicht in wässrigen Lösungen verwendet.
