Calciumsulfat (CaSO4) ist ein weißes Pulver, das natürlicherweise vorkommt oder industriell hergestellt wird. Aufgrund seiner Eigenschaften als Bindemittel, Füllstoff und Nährstoff wird es im Baugewerbe, in der Lebensmittelindustrie und in der Medizin eingesetzt.
| IUPAC-Name | Calciumsulfat |
| Molekularformel | CaSO4 |
| CAS-Nummer | 7778-18-9 |
| Synonyme | Gips, wasserfreier Gips, Anhydrit, Dihydrat, Calciumsalz, Selenit |
| InChI | InChI=1S/Ca.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Eigenschaften von Calciumsulfat
Calciumsulfat-Formel
Die chemische Formel für Calciumsulfat lautet CaSO4. Das bedeutet, dass jedes Calciumsulfatmolekül ein Calciumatom, ein Schwefelatom und vier Sauerstoffatome enthält. Die Formel wird verwendet, um die Zusammensetzung von Calciumsulfat in chemischen Gleichungen darzustellen und die Menge an Reaktanten zu berechnen, die bei chemischen Reaktionen benötigt wird.
Molmasse von Calciumsulfat
Die Molmasse von CaSO4 beträgt etwa 136,14 g/mol. Dieser Wert wird berechnet, indem die Atommassen eines Calciumatoms, eines Schwefelatoms und vier Sauerstoffatomen in der Verbindung addiert werden. Die Molmasse wird verwendet, um die Menge an CaSO4 zu bestimmen, die bei chemischen Reaktionen benötigt wird, und um seine Konzentration in Lösungen zu berechnen.
Siedepunkt von Calciumsulfat
CaSO4 hat keinen definierten Siedepunkt, da es vor Erreichen seines Siedepunkts einer thermischen Zersetzung unterliegt. Es kann jedoch auf Temperaturen über 200 °C erhitzt werden, ohne dass es zu einer Zersetzung kommt. Bei höheren Temperaturen zersetzt sich CaSO4 endotherm unter Bildung von Calciumoxid und Schwefeltrioxid.
Schmelzpunkt von Calciumsulfat
Der Schmelzpunkt von CaSO4 hängt von seinem Hydratationszustand ab. Die wasserfreie Form von CaSO4 hat einen Schmelzpunkt von etwa 1460 °C, während die Dihydratform einen niedrigeren Schmelzpunkt von etwa 128 °C hat. Die Halbhydrat- und Trihydratformen haben mittlere Schmelzpunkte.
Dichte von Calciumsulfat g/ml
Die Dichte von CaSO4 hängt von seiner Form und seinem Hydratationszustand ab. Die wasserfreie Form von CaSO4 hat eine Dichte von etwa 2,96 g/ml, während die Dihydratform eine Dichte von etwa 2,32 g/ml hat. Die halbhydratisierten und trihydratisierten Formen haben mittlere Dichten.
Molekulargewicht von Calciumsulfat
Das Molekulargewicht von CaSO4 beträgt etwa 136,14 g/mol. Dieser Wert wird berechnet, indem die Atommassen eines Calciumatoms, eines Schwefelatoms und vier Sauerstoffatomen in der Verbindung addiert werden. Das Molekulargewicht wird verwendet, um die Menge an CaSO4 zu berechnen, die bei chemischen Reaktionen benötigt wird, und um seine Konzentration in Lösungen zu bestimmen.
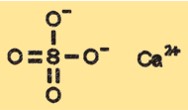
Struktur von Calciumsulfat
CaSO4 hat eine Kristallstruktur, die je nach Hydratationszustand variieren kann. Die wasserfreie Form von CaSO4 weist eine als orthorhombisch klassifizierte Kristallstruktur auf, während die Dihydratform eine monokline Kristallstruktur aufweist. Die Halbhydrat- und Trihydratformen haben unterschiedliche Kristallstrukturen, die zwischen den wasserfreien und Dihydratformen liegen.
| Aussehen | Weißes oder festes Pulver |
| Spezifisches Gewicht | 2,96 (wasserfrei), 2,32 (Dihydrat) |
| Farbe | Weiß oder farblos |
| Geruch | Geruchlos |
| Molmasse | 136,14 g/Mol |
| Dichte | 2,96 g/cm³ (wasserfrei), 2,32 g/cm³ (Dihydrat) |
| Fusionspunkt | 1460°C (wasserfrei), 128°C (Dihydrat) |
| Siedepunkt | Hat keinen definierten Siedepunkt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 0,24 g/100 ml (20 °C) |
| Löslichkeit | Löslich in Wasser und Glycerin, unlöslich in Ethanol |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | 9,8 (erste Dissoziation), 11,8 (zweite Dissoziation) |
| pH-Wert | 7 (neutral) |
Sicherheit und Gefahren von Calciumsulfat
CaSO4 gilt im Allgemeinen als sicher in der Anwendung und Handhabung, kann jedoch bei unsachgemäßer Handhabung einige Gesundheitsrisiken bergen. Das Einatmen von CaSO4-Staub kann zu Reizungen der Atemwege führen, während die Einnahme großer Mengen der Verbindung zu Magen-Darm-Beschwerden führen kann. Augen- und Hautkontakt mit CaSO4 kann zu Reizungen oder Trockenheit führen. CaSO4 kann auch mit bestimmten Chemikalien reagieren und gefährliche Nebenprodukte erzeugen. Daher sollte beim Umgang mit CaSO4 geeignete persönliche Schutzausrüstung getragen und an einem kühlen, trockenen und gut belüfteten Ort, entfernt von inkompatiblen Materialien, gelagert werden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Gesundheitsschädlich beim Verschlucken. Verursacht Haut- und Augenreizungen. |
| UN-Identifikationsnummern | Nicht reguliert |
| HS-Code | 2833.29.00 |
| Gefahrenklasse | Nicht als gefährlicher Stoff oder gefährliches Gemisch gemäß Verordnung (EG) Nr. 1272/2008 [CLP] eingestuft. |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | LD50 (oral, Ratte): > 2000 mg/kg |
Methoden zur Calciumsulfat-Synthese
Verschiedene Methoden ermöglichen die Synthese von CaSO4 abhängig von der gewünschten Form und dem Hydratationszustand der Verbindung.
Eine übliche Methode ist die Reaktion von Calciumcarbonat oder Calciumoxid mit Schwefelsäure. Bei der Reaktion entstehen CaSO4 und Kohlendioxid bzw. Wasser.
Eine andere Methode beinhaltet die Reaktion von Calciumchlorid mit Natriumsulfat , was zur Ausfällung von CaSO4 führt. Durch thermische Dehydratisierung von Gips, einer natürlichen mineralischen Form von CaSO4-Dihydrat, entsteht CaSO4.
Bei einigen industriellen Prozessen, beispielsweise bei der Rauchgasentschwefelung von Kraftwerken, entsteht CaSO4 als Nebenprodukt. Bei diesem Prozess reagiert Schwefeldioxid mit Calciumcarbonat zu Calciumsulfit, das oxidiert wird und so CaSO4 entsteht.
Die für CaSO4 verwendete Synthesemethode kann seine Eigenschaften wie Partikelgröße, Kristallinität und Reinheit beeinflussen. Daher ist es wichtig, die für die beabsichtigte Anwendung des Präparats geeignete Methode zu wählen.
Verwendung von Calciumsulfat
CaSO4 findet aufgrund seiner einzigartigen Eigenschaften, darunter geringe Toxizität, hoher Schmelzpunkt und weiße Farbe, viele Einsatzmöglichkeiten in verschiedenen Branchen. Zu den häufigsten Anwendungen von CaSO4 gehören:
- Konstruktion: Ein wichtiger Bestandteil von Zement und Gipskartonplatten, wo es als Bindemittel und Kitt fungiert.
- Lebensmittel und Getränke: Wird als Gerinnungsmittel bei der Herstellung von Tofu und als Festigungsmittel in einigen Käsesorten und Gemüsekonserven verwendet.
- Pharmazeutika: Wird als Füllstoff und Bindemittel bei der Herstellung von Tabletten und Kapseln verwendet.
- Landwirtschaft: Wird als Bodenverbesserungsmittel verwendet, um die Bodenstruktur zu verbessern und den Ernteertrag zu steigern.
- Chemikalien: Wird bei der Herstellung verschiedener Chemikalien wie Pigmenten, Papier- und Textilverarbeitung verwendet.
- Kosmetika: Wird in kosmetischen Formulierungen als Füll- und Trübungsmittel verwendet.
- Wasseraufbereitung: Wird bei der Wasseraufbereitung verwendet, um Verunreinigungen zu entfernen und Ablagerungen zu reduzieren.
- Kunststoffe und Gummi: Wird als Füll- und Verstärkungsmittel in Kunststoff- und Gummiprodukten verwendet.
Fragen:
F: Ist Calciumsulfat vegan?
A: Ja, CaSO4 gilt als vegan, da es nicht aus tierischen Quellen stammt.
F: Was war die Hauptanwendung von Calciumsulfat in Krankenhäusern?
A: CaSO4 wurde in Krankenhäusern häufig als Gipsverband für Knochenbrüche verwendet.
F: Welche Mengen an Calciumsulfat und Phosphor?
A: Diese Frage ist unvollständig und erfordert weitere Informationen, um eine konkrete Antwort zu geben.
F: Ist CaSO4 wasserlöslich?
A: CaSO4 hat eine geringe Wasserlöslichkeit, mit einer Löslichkeit von etwa 2,05 g/L bei Raumtemperatur.
F: Ist CaSO4 löslich?
A: Calciumsulfat hat eine geringe Wasserlöslichkeit, mit einer Löslichkeit von etwa 2,05 g/L bei Raumtemperatur.
F: Wie groß ist die Molmasse von CaSO4?
A: Die Molmasse von CaSO4 beträgt etwa 136,14 g/mol.
F: Welches Salz hat einen pH-Wert < 7? KBr, HCOOK, CaSO4, NH4NO3
A: Keines der aufgeführten Salze hat in reiner Form einen pH-Wert < 7. Wenn NH4NO3 (Ammoniumnitrat) jedoch in Wasser gelöst wird, entsteht eine saure Lösung mit einem pH-Wert < 7.
