Calciumthiosulfat (CaO3S2) ist eine Verbindung aus Calcium, Sauerstoff und Schwefel. Es wird häufig in der medizinischen und landwirtschaftlichen Industrie als Düngemittel und zur Behandlung bestimmter Erkrankungen eingesetzt.
| IUPAC-Name | Calciumthiosulfat |
| Molekularformel | CaO3S2 |
| CAS-Nummer | 10124-41-1 |
| Synonyme | Calciumhyposulfit; Calciumthiosulfat; Calciumsulfat; Calciumthiosulfonat |
| InChI | InChI=1S/Ca.H2O3S2/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Eigenschaften von Calciumthiosulfat
Calciumthiosulfat-Formel
Die chemische Formel für Calciumthiosulfat lautet CaS2O3. Es gibt die Art und Anzahl der Atome in einem Molekül an. Mithilfe der Formel können die Molmasse und andere Eigenschaften der Verbindung bestimmt werden.
Molmasse von Calciumthiosulfat
Die Molmasse von CaO3S2 beträgt 152,18 g/mol. Es besteht aus einem Calciumatom, drei Sauerstoffatomen und zwei Schwefelatomen. Die Molmasse ist eine wichtige Eigenschaft, die in chemischen Berechnungen verwendet wird, um beispielsweise zu bestimmen, wie viel einer Substanz benötigt wird, um eine bestimmte Reaktion hervorzurufen.
Siedepunkt von Calciumthiosulfat
CaO3S2 hat keinen eindeutigen Siedepunkt, da es sich vor dem Sieden zersetzt. Bei etwa 75 °C beginnt es sich zu zersetzen und setzt Schwefeldioxid frei. Der Siedepunkt eines Stoffes ist die Temperatur, bei der er bei einem bestimmten Druck vom flüssigen in den gasförmigen Zustand übergeht.
Schmelzpunkt von Calciumthiosulfat
Der Schmelzpunkt von CaO3S2 beträgt 155°C. Bei dieser Temperatur geht die feste Verbindung von fest in flüssig über. Der Schmelzpunkt ist eine wichtige Eigenschaft zur Identifizierung und Klassifizierung von Stoffen.
Dichte von Calciumthiosulfat g/ml
Die Dichte von CaO3S2 beträgt 2,67 g/ml. Die Dichte ist die Menge an Masse pro Volumeneinheit. Anhand der Dichte eines Stoffes lässt sich bestimmen, ob er in einem anderen Stoff, beispielsweise Wasser, schwimmt oder sinkt.
Molekulargewicht von Calciumthiosulfat
Das Molekulargewicht von CaO3S2 beträgt 152,18 g/mol. Es ist die Summe der Atomgewichte aller Atome in einem Molekül. Mithilfe des Molekulargewichts werden verschiedene Eigenschaften eines Stoffes berechnet, beispielsweise seine Molarität oder Konzentration.
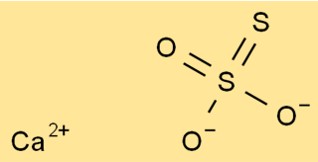
Struktur von Calciumthiosulfat
Die Struktur von CaO3S2 besteht aus einem Ca2+-Ion und einem S2O32–Ion. Das Thiosulfat-Ion hat ein zentrales Schwefelatom, an das vier Sauerstoffatome gebunden sind. Zwei der Sauerstoffatome sind doppelt gebunden und zwei sind einfach gebunden.
Löslichkeit von Calciumthiosulfat
CaO3S2 ist in Wasser leicht löslich, mit einer Löslichkeit von etwa 16 g/L bei Raumtemperatur. Es ist in heißem Wasser löslicher als in kaltem Wasser. Löslichkeit ist die maximale Menge eines Stoffes, die sich in einem bestimmten Lösungsmittel bei einer bestimmten Temperatur und einem bestimmten Druck lösen kann.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2,67 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 152,18 g/Mol |
| Dichte | 2,67 g/ml |
| Fusionspunkt | 155°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 16 g/L bei Raumtemperatur |
| Löslichkeit | In Wasser schwer löslich |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 7.2 (Dissoziation von Thioschwefelsäure) |
| pH-Wert | 6,0–8,5 (1 %ige wässrige Lösung) |
Sicherheit und Gefahren von Calciumthiosulfat
CaO3S2 gilt im Allgemeinen als sicher, wenn es ordnungsgemäß gehandhabt und verwendet wird. Beim Einatmen kann es jedoch zu Haut- und Augenreizungen sowie Atembeschwerden kommen. Bei Verschlucken kann es auch zu Magen-Darm-Reizungen kommen. Beim Umgang mit dieser Verbindung ist es wichtig, geeignete persönliche Schutzausrüstung wie Handschuhe und Augenschutz zu tragen. Bei Hautkontakt muss diese mit reichlich Wasser abgewaschen werden. Bei Augenkontakt mindestens 15 Minuten mit Wasser spülen. Bei Verschlucken oder Einatmen sofort einen Arzt aufsuchen. CaO3S2 sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von inkompatiblen Materialien, gelagert werden.
| Gefahrensymbole | Xi (irritierend) |
| Sicherheitsbeschreibung | Einatmen von Staub/Rauch/Gas/Nebel/Dampf/Spray vermeiden. Schutzhandschuhe/Schutzkleidung/Augenschutz/Gesichtsschutz tragen. |
| UN-Identifikationsnummern | Nicht reguliert |
| HS-Code | 2832.10.00 |
| Gefahrenklasse | 6.1 (giftig) |
| Verpackungsgruppe | III |
| Toxizität | LD50 (oral, Ratte) 1064 mg/kg; LC50 (Inhalation, Ratte) >2.000 mg/m3 |
Methoden zur Synthese von Calciumthiosulfat
Es gibt verschiedene Methoden zur Synthese von CaO3S2.
Eine Methode beinhaltet die Reaktion von Calciumhydroxid (Ca(OH)2) mit Na2S2O3 in Wasser, um CaO3S2 und Natriumhydroxid (NaOH) zu erzeugen.
Eine andere Methode besteht darin , Calciumsulfat (CaSO4) mit Natriumsulfit (Na2SO3) und Schwefel (S) in Wasser zu reagieren, um CaO3S2 und Natriumsulfat (Na2SO4) zu erzeugen.
CaO3S2 kann durch Reaktion von Schwefel (S) und Sauerstoff (O2) mit Calciumoxid (CaO) oder Calciumcarbonat (CaCO3) in Wasser gewonnen werden. Bei dieser Methode entstehen als Nebenprodukte CaO3S2, Calciumsulfat (CaSO4) und Kohlendioxid (CO2).
Zur Synthese von CaO3S2 kann Na2S2O3 mit Calciumchlorid (CaCl2) in Wasser umgesetzt werden. Bei dieser Methode entstehen als Nebenprodukte CaO3S2 und Natriumchlorid (NaCl).
Eine andere Methode beinhaltet die Reaktion von Calciumhydroxid (Ca(OH)2) mit Schwefeldioxid (SO2) und Sauerstoff (O2) in Wasser, um CaO3S2 und Calciumsulfit (CaSO3) als Nebenprodukte zu erzeugen.
Verwendung von Calciumthiosulfat
CaO3S2 wird in unterschiedlichen Industriezweigen vielfältig eingesetzt. Zu seinen Verwendungsmöglichkeiten gehören:
- Landwirtschaft – Wird als Dünger verwendet, um Pflanzen mit Kalzium und Schwefel zu versorgen.
- Fotografie – Wird als Fixiermittel bei der fotografischen Entwicklung verwendet, um überschüssiges Silberhalogenid von Drucken und Negativen zu entfernen.
- Wasseraufbereitung – Wird verwendet, um Chlor aus Wasser zu entfernen und Chlor im Abwasser zu neutralisieren.
- Medizin – Wird zur Behandlung von Zyanidvergiftungen verwendet, da es mit Zyanid unter Bildung des weniger giftigen Thiocyanats reagiert.
- Industriell – Wird in verschiedenen industriellen Prozessen verwendet, z. B. bei der Zellstoff- und Papierherstellung, der Erdölraffinierung und der Textilverarbeitung.
- Lebensmittelindustrie – Wird als Lebensmittelkonservierungsmittel verwendet, um das Wachstum von Bakterien zu verhindern und die Frische von Lebensmitteln zu erhalten.
- Tiergesundheit – Wird als Nahrungsergänzungsmittel für Tiere verwendet, um sie mit Kalzium und Schwefel zu versorgen.
- Kosmetik – Wird in der Kosmetik als Haarpflegemittel und Hautfeuchtigkeitsspender verwendet.
Fragen:
F: Was ist wasserlöslicher, Calciumthiosulfat oder Strontiumthiosulfat?
A: CaO3S2 ist in Wasser löslicher als Strontiumthiosulfat.
F: Was wäre Ihrer Meinung nach wasserlöslicher, Strontiumthiosulfat oder Calciumthiosulfat?
A: CaO3S2 sollte in Wasser besser löslich sein als Strontiumthiosulfat.
F: Was macht ein Calciumthiosulfat-Entchlorungsatom aus?
A: Ein CaO3S2-Entchlorungsatom besteht aus einem Calciumatom, drei Sauerstoffatomen, zwei Schwefelatomen und zwei Thiosulfationen.
F: Wie erkennt man Calciumthiosulfat?
A: CaO3S2 kann anhand seiner physikalischen und chemischen Eigenschaften sowie durch verschiedene Analysetechniken wie Infrarotspektroskopie und Röntgenbeugung identifiziert werden.
F: Was bedeuten die Zahlen in Calciumthiosulfat?
A: Die Zahlen in CaO3S2 beziehen sich auf die Anzahl der Atome jedes in der Verbindung vorhandenen Elements. CaO3S2 zeigt beispielsweise an, dass es ein Calciumatom, drei Sauerstoffatome und zwei Schwefelatome gibt.
F: Was ist eine Wasseraufbereitung mit Kalziumthiosulfat?
A: CaO3S2 wird in der Wasseraufbereitung verwendet, um Chlor aus dem Wasser zu entfernen und Chlor im Abwasser zu neutralisieren.
F: Gibt es Calciumthiosulfat-Tabletten?
A: Ja, CaO3S2-Tabletten sind als Nahrungsergänzungsmittel für Tiere erhältlich und versorgen diese mit Kalzium und Schwefel.
