Calciumphosphat (Ca3(PO4)2) ist ein Mineral, das in Zähnen und Knochen vorkommt. Dies trägt dazu bei, dass sie stark und gesund werden. Es wird auch als Nahrungsergänzungsmittel zur Vorbeugung von Kalziummangel eingesetzt.
| IUPAC-Name | Calciumphosphat |
| Molekularformel | Ca3(PO4)2 |
| CAS-Nummer | 7758-87-4 |
| Synonyme | Tricalciumphosphat, Knochenphosphat, Calciumorthophosphat, tribasisches Calciumphosphat, TCP |
| InChI | InChI=1S/3Ca.2H3O4P/c;;;2 1-5(2,3)4/h;;;2 (H3,1,2,3,4)/q3*+2;;/p-6 |
Eigenschaften von Calciumphosphat
Calciumphosphat-Formel
Die chemische Formel für Calciumphosphat lautet Ca3(PO4)2, was darauf hinweist, dass es drei Calciumionen und zwei Phosphationen enthält. Mit der Formel wird die Menge an Calciumphosphat berechnet, die für chemische Reaktionen benötigt wird. Calciumphosphat ist ein wichtiger Bestandteil von Zähnen und Knochen und wird auch in verschiedenen industriellen Anwendungen verwendet, beispielsweise als Lebensmittelzusatzstoffe und Düngemittel.
Molmasse von Calciumphosphat
Die Molmasse von Ca3(PO4)2 beträgt 310,18 g/mol. Sie wird durch Addition der Atommasse von Calcium, Phosphor und Sauerstoff berechnet, die jeweils 40,08 g/mol, 30,97 g/mol und 15,99 g/mol beträgt. Die Molmasse ist ein wichtiger Parameter zur Bestimmung der Menge an Ca3(PO4)2, die in einer chemischen Reaktion benötigt wird.
Siedepunkt von Calciumphosphat
Ca3(PO4)2 hat keinen eindeutigen Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Beim Erhitzen zerfällt Ca3(PO4)2 in Calciumoxid und Phosphorpentoxid und setzt dabei Wasserdampf frei. Die Zersetzungstemperatur hängt von der Art des Ca3(PO4)2 und der Heizrate ab.
Schmelzpunkt von Calciumphosphat
Der Schmelzpunkt von Ca3(PO4)2 hängt von der Art des Ca3(PO4)2 ab. Der Schmelzpunkt von Tricalciumphosphat, der in der Natur am häufigsten vorkommenden Form von Ca3(PO4)2, liegt bei etwa 1670 °C. Dicalciumphosphat hat einen Schmelzpunkt von etwa 1400 °C, während Monocalciumphosphat bei etwa 109 °C schmilzt.
Dichte von Calciumphosphat g/ml
Die Dichte von Ca3(PO4)2 variiert je nach Ca3(PO4)2-Typ. Tricalciumphosphat hat eine Dichte von etwa 3,14 g/ml, während Dicalciumphosphat eine Dichte von etwa 2,31 g/ml hat. Monocalciumphosphat hat eine Dichte von etwa 2,22 g/ml.
Molekulargewicht von Calciumphosphat
Das Molekulargewicht von Ca3(PO4)2 beträgt 310,18 g/mol, was der Summe der Atomgewichte von Calcium, Phosphor und Sauerstoff entspricht. Das Molekulargewicht ist wichtig für die Berechnung der Menge an Ca3(PO4)2, die für chemische Reaktionen benötigt wird.
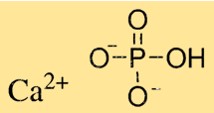
Struktur von Calciumphosphat
Ca3(PO4)2 hat eine komplexe Kristallstruktur, die von der Art des Ca3(PO4)2 abhängt. Tricalciumphosphat hat eine hexagonale Kristallstruktur, während Dicalciumphosphat eine monokline Kristallstruktur hat. Monocalciumphosphat hat eine tetragonale Kristallstruktur. Ca3(PO4)2-Kristalle bestehen aus Calciumionen und Phosphationen, die in einem bestimmten Muster angeordnet sind.
| Aussehen | Weißes Pulver oder Kristalle |
| Spezifisches Gewicht | 3.14 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 310,18 g/Mol |
| Dichte | 3,14 g/ml (Tricalciumphosphat) |
| Fusionspunkt | 1670 °C (Tricalciumphosphat) |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | N / A |
| Löslichkeit in Wasser | 0,002 g/100 ml (bei 25°C) |
| Löslichkeit | Löslich in Säuren, unlöslich in Wasser |
| Dampfdruck | N / A |
| Wasserdampfdichte | N / A |
| pKa | pKa1: 1,9, pKa2: 6,7, pKa3: 12,0 |
| pH-Wert | 5,5–7,5 (10 % Suspension in Wasser) |
Sicherheit und Gefahren von Calciumphosphat
Ca3(PO4)2 gilt allgemein als sicher für den menschlichen Verzehr und stellt keine nennenswerten Gesundheitsrisiken dar. Es ist ein natürliches Mineral, das in Knochen und Zähnen vorkommt und in vielen Formen als Nahrungsergänzungsmittel verwendet wird. Ca3(PO4)2 wird auch in der Lebensmittelindustrie als Lebensmittelzusatzstoff und Teigverbesserer verwendet. Allerdings kann der übermäßige Verzehr von Ca3(PO4)2-Nahrungsergänzungsmitteln zu Nebenwirkungen wie Magenbeschwerden, Verstopfung und sogar Nierenschäden führen. Darüber hinaus kann die Exposition gegenüber hohen Konzentrationen von Ca3(PO4)2-Staub am Arbeitsplatz zu Atemwegserkrankungen führen. Daher ist es wichtig, Ca3(PO4)2-Ergänzungsmittel und -Produkte in Maßen zu verwenden und die Richtlinien zur Arbeitssicherheit zu befolgen.
| Gefahrensymbole | Keine bekannt |
| Sicherheitsbeschreibung | 26-36/37/39: Tragen Sie geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz. |
| UN-Identifikationsnummern | N / A |
| HS-Code | 28352500 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität |
Methoden zur Calciumphosphatsynthese
Es gibt verschiedene Methoden zur Synthese von Ca3(PO4)2, darunter Fällung, hydrothermale Synthese, Sol-Gel-Verfahren und Festkörperreaktion.
Bei der Fällungsmethode werden Calcium- und Phosphationen in einer wässrigen Lösung kombiniert, wodurch durch eine chemische Reaktion ein Niederschlag entsteht. Anschließend wäscht und trocknet der Experimentator den Niederschlag, um die gewünschte Ca3(PO4)2-Verbindung zu erhalten.
Bei der hydrothermischen Synthese handelt es sich um die Reaktion von Kalzium- und Phosphatquellen in einer Umgebung mit hohem Druck und hoher Temperatur. Um die gewünschte Ca3(PO4)2-Verbindung zu erhalten, wird das resultierende Produkt gewaschen und getrocknet.
Beim Sol-Gel-Verfahren wird ein Sol oder eine kolloidale Suspension in ein Gel umgewandelt und dann getrocknet, um die gewünschte Ca3(PO4)2-Verbindung zu erhalten. Diese Methode ermöglicht eine genaue Kontrolle der Zusammensetzung und Morphologie der erhaltenen Verbindung.
Bei der Festkörperreaktion werden Calciumpyrophosphat und Calciumcarbonat im festen Zustand gemischt und anschließend erhitzt, um eine chemische Reaktion zu fördern. Um die gewünschte Ca3(PO4)2-Verbindung zu erhalten, muss das erhaltene Produkt gewaschen und getrocknet werden.
Verwendung von Calciumphosphat
Ca3(PO4)2 findet aufgrund seiner einzigartigen Eigenschaften viele Einsatzmöglichkeiten in verschiedenen Branchen. Einige der häufigsten Anwendungen von Ca3(PO4)2 sind:
- Nahrungsergänzungsmittel: Wird häufig in Nahrungsergänzungsmitteln als Quelle für Kalzium und Phosphor verwendet, die essentielle Mineralien für die Knochengesundheit sind.
- Lebensmittel- und Getränkeindustrie: Wird als Lebensmittelzusatzstoff in vielen verarbeiteten Lebensmitteln verwendet, darunter Backwaren, Milchprodukte und Getränke. Beim Backen wird es als Backmittel und Kalziumquelle verwendet.
- Pharmazeutische Industrie: Wird in der pharmazeutischen Industrie als Füllstoff und Bindemittel in Tabletten und Kapseln verwendet. Die Bioverfügbarkeit einiger Arzneimittel kann durch die Verwendung als Überzugsmittel verbessert werden.
- Landwirtschaft: Wird als Dünger verwendet, um Pflanzen mit essentiellen Nährstoffen wie Kalzium und Phosphor zu versorgen.
- Zahnheilkunde: Wird in der Zahnheilkunde zur Remineralisierung der Zähne und zur Wiederherstellung des Zahnschmelzes verwendet.
- Biomedizinische Technik: Wird auch in der biomedizinischen Technik zur Entwicklung von Knochentransplantatersatzstoffen und zur Verbesserung der Eigenschaften von Biomaterialien verwendet, die bei der Knochengewebetechnik verwendet werden.
Fragen:
F: Warum erhöht die Zugabe von Säure die Löslichkeit von Calciumphosphat?
A: Die Zugabe von Säure erhöht die Löslichkeit von Ca3(PO4)2 durch Protonierung der Phosphationen, wodurch sie wasserlöslicher werden. Protonierte Phosphationen bilden saures Ca3(PO4)2, das löslicher ist als die neutrale Form.
F: Wie viele Gramm Phosphor sind in 500,0 Gramm Calciumphosphat enthalten?
A: Die Molmasse von Ca3(PO4)2 beträgt 310,18 g/mol. Die Verbindung hat ein Phosphor/Kalzium-Verhältnis von 2:3, die Molmasse von Phosphor beträgt also 30,97 g/mol. In 500,0 Gramm Ca3(PO4)2 stecken also 81,62 Gramm Phosphor.
F: Ist Calciumphosphat löslich?
A: Ca3(PO4)2 hat eine geringe Wasserlöslichkeit mit einer Produktlöslichkeit von 1,8 x 10^-29. Allerdings kann die Löslichkeit durch Zugabe von Säuren erhöht werden.
F: Wie hoch ist der Massenanteil an Sauerstoff in Calciumphosphat?
A: Die Molmasse von Ca3(PO4)2 beträgt 310,18 g/mol. Die Atommasse von Sauerstoff beträgt 16,00 g/mol und ein Mol Ca3(PO4)2 enthält 8 Sauerstoffatome. Daher beträgt die Sauerstoffmasse in einem Mol Ca3(PO4)2 8 x 16,00 = 128,00 g. Die Masse von Ca3(PO4)2 beträgt 310,18 g, daher beträgt der Massenanteil an Sauerstoff (128,00 g / 310,18 g) x 100 % = 41,23 %.
F: Ist Ca3(PO4)2 wasserlöslich?
A: Ca3(PO4)2 ist in Wasser nicht sehr löslich, mit einer Produktlöslichkeit von 1,3 x 10^-33.
F: Wie groß ist die Molmasse von Ca3(PO4)2?
A: Die Molmasse von Ca3(PO4)2 beträgt 310,18 g/mol.
F: Was ist Ca3(PO4)2?
A: Ca3(PO4)2 ist eine chemische Verbindung, die aus drei Ca2+-Ionen und zwei PO43–Ionen besteht. Es ist ein weißes Pulver, geruchlos und wasserunlöslich.
F: Wie lautet die Formelmasse in Gramm Ca3(PO4)2?
A: Die Formelmasse in Gramm Ca3(PO4)2 beträgt 310,18 g/mol.
