Calciumperchlorat (Ca(ClO4)2) ist eine chemische Verbindung, die vielfältige Verwendung findet, unter anderem in Feuerwerkskörpern und Raketentreibstoffen. Es ist gut wasserlöslich und kann auch als Trockenmittel verwendet werden.
| IUPAC-Name | Calciumperchlorat |
| Molekularformel | Ca(ClO4)2 |
| CAS-Nummer | 13477-36-6 |
| Synonyme | Calciofos, Calciumsalz der Perchlorsäure, Calciumdiperchlorat, Calcium(II)perchlorat, UN1459 |
| InChI | InChI=1S/Ca.2ClHO4/c;2 2-1(3,4)5/h;2 (H,2,3,4,5)/q+2;;/p-2 |
Eigenschaften von Calciumperchlorat
Calciumperchlorat-Formel
Die Formel für Calciumperchlorat lautet Ca(ClO4)2. Es besteht aus einem Ca2+-Ion und zwei ClO4–Ionen. Das Calciumion hat eine positive Ladung von 2+ und jedes ClO4–Ion hat eine negative Ladung von 1-. Diese Formel wird verwendet, um die chemische Struktur von Calciumperchlorat darzustellen.
Molmasse von Calciumperchlorat
Die Molmasse von Ca(ClO4)2 beträgt 238,98 g/mol. Dieser Wert stellt die Masse eines Mols Ca(ClO4)2 dar, das die Avogadro-Anzahl an Molekülen enthält. Die Molmasse ist wichtig, um die Menge an Ca(ClO4)2 zu bestimmen, die in einer bestimmten Reaktion benötigt wird.
Siedepunkt von Calciumperchlorat
Ca(ClO4)2 hat keinen Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Beim Erhitzen zerfällt es in Calciumchlorid, Sauerstoffgas und Chlorgas. Diese Zersetzungsreaktion ist stark exotherm und setzt eine erhebliche Menge Wärme frei.
Schmelzpunkt von Calciumperchlorat
Der Schmelzpunkt von Ca(ClO4)2 beträgt 200°C. Diese Temperatur ist der Punkt, an dem festes Ca(ClO4)2 in einen flüssigen Zustand übergeht. Der Schmelzpunkt ist wichtig für die Bestimmung der physikalischen Eigenschaften von Ca(ClO4)2, beispielsweise seiner Fähigkeit, als Trocknungsmittel verwendet zu werden.
Dichte von Calciumperchlorat g/ml
Die Dichte von Ca(ClO4)2 beträgt 2,505 g/ml. Dieser Wert gibt die Massemenge pro Volumeneinheit Ca(ClO4)2 an. Die Dichte von Ca(ClO4)2 ist größer als die von Wasser, was bedeutet, dass es im Wasser versinkt.
Molekulargewicht von Calciumperchlorat
Das Molekulargewicht von Ca(ClO4)2 beträgt 238,98 g/mol. Dieser Wert stellt die Summe der Atomgewichte aller Atome in einem Ca(ClO4)2-Molekül dar. Das Molekulargewicht ist wichtig, um die Menge an Ca(ClO4)2 zu bestimmen, die in einer bestimmten Reaktion benötigt wird.
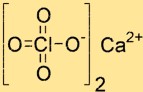
Struktur von Calciumperchlorat
Die Struktur von Ca(ClO4)2 besteht aus einem Ca2+-Ion und zwei ClO4–Ionen. Das Ca2+-Ion befindet sich im Zentrum der Struktur und ist von vier Sauerstoffatomen umgeben, die von zwei ClO4–Ionen stammen. Die ClO4-Ionen haben eine tetraedrische Form und sind über Sauerstoffatome mit dem Calciumion verbunden.
Löslichkeit von Calciumperchlorat
Ca(ClO4)2 ist in Wasser gut löslich, mit einer Löslichkeit von 121 g/100 ml bei 20 °C. Diese Löslichkeit macht es als Trocknungsmittel nützlich, da es Wasser aus seiner Umgebung aufnehmen kann. Allerdings ist es in organischen Lösungsmitteln wie Ethanol und Aceton unlöslich.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2.505 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 238,98 g/Mol |
| Dichte | 2.505 g/ml |
| Fusionspunkt | 200°C |
| Siedepunkt | Zersetzt sich vor dem Siedepunkt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 121 g/100 ml bei 20 °C |
| Löslichkeit | Unlöslich in organischen Lösungsmitteln |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Calciumperchlorat
Ca(ClO4)2 birgt mehrere Sicherheitsrisiken und beim Umgang damit sollten entsprechende Sicherheitsmaßnahmen getroffen werden. Es ist ein starkes Oxidationsmittel, das mit brennbaren Materialien reagieren und einen Brand oder eine Explosion verursachen kann. Das Einatmen von Staub oder Dämpfen kann zu Reizungen der Atemwege führen, und bei Hautkontakt kann es zu Reizungen oder Verbrennungen kommen. Es ist außerdem schädlich, wenn es eingenommen wird und zu Reizungen oder Verätzungen des Verdauungstrakts führt. Beim Umgang mit Ca(ClO4)2 sollte angemessene persönliche Schutzausrüstung wie Handschuhe und Schutzbrille getragen und von brennbaren Materialien und unverträglichen Substanzen entfernt gelagert werden.
| Gefahrensymbole | Oxidationsmittel, gesundheitsschädlich beim Verschlucken |
| Sicherheitsbeschreibung | Von brennbaren Materialien und unverträglichen Substanzen fernhalten. Tragen Sie Handschuhe und Schutzbrille. Vermeiden Sie das Einatmen von Staub oder Dämpfen. Bei Kontakt mit viel Wasser abwaschen und ggf. einen Arzt aufsuchen. |
| UN-Identifikationsnummern | UN1502 |
| HS-Code | 2829.9000 |
| Gefahrenklasse | 5.1 – Oxidierende Stoffe |
| Verpackungsgruppe | II |
| Toxizität | Gesundheitsschädlich beim Verschlucken, Reizung der Haut und der Atemwege |
Methoden zur Synthese von Calciumperchlorat
Ca(ClO4)2 kann durch Reaktion von Calciumhydroxid mit Perchlorsäure oder Ammoniumperchlorat synthetisiert werden.
Eine Methode besteht darin , Calciumcarbonat mit Perchlorsäure in einem Reaktionsgefäß umzusetzen und anschließend die Lösung zu filtrieren und einzudampfen, um das feste Produkt zu erhalten.
Eine andere Methode beinhaltet die Reaktion von Calciumoxid mit einer wässrigen Perchlorsäurelösung, gefolgt von der Filtration und Trocknung des resultierenden Produkts.
In einigen Fällen kann Ca(ClO4)2 durch Reaktion von Calciumchlorid mit Natriumperchlorat in einem Reaktionsgefäß synthetisiert werden. Das Produkt kann filtriert und getrocknet werden, um nach der Reaktion Ca(ClO4)2 zu erhalten.
Eine weitere beliebte Methode zur Synthese von Ca(ClO4)2 beinhaltet die Reaktion von Calciumchlorid mit Ammoniumperchlorat, wobei Ca(ClO4)2 und Ammoniumchlorid als Nebenprodukte entstehen. Pyrotechnische Anwendungen bevorzugen diese Methode aufgrund ihrer Fähigkeit, hochreines Ca(ClO4)2 herzustellen.
Es ist wichtig zu beachten, dass beim Arbeiten mit Perchlorsäure entsprechende Sicherheitsvorkehrungen getroffen werden müssen, da es sich um ein starkes Oxidationsmittel handelt, das mit organischen Materialien reagieren und einen Brand oder eine Explosion verursachen kann.
Verwendungsmöglichkeiten von Calciumperchlorat
Ca(ClO4)2 hat vielfältige Einsatzmöglichkeiten in verschiedenen Branchen und Anwendungen. Einige der Verwendungsmöglichkeiten von Ca(ClO4)2 sind:
- Pyrotechnik: Wird aufgrund seines hohen Sauerstoffgehalts und seiner Stabilität häufig in der Pyrotechnik als Oxidationsmittel verwendet.
- Düngemittel: Wird in Düngemitteln verwendet, um Pflanzen mit Kalzium und Chlor zu versorgen, die für ihr Wachstum wichtige Nährstoffe sind.
- Raketentreibstoff: Wird aufgrund seines hohen Sauerstoffgehalts und seiner Stabilität als Bestandteil von Raketentreibstoff verwendet.
- Erdölraffinierung: Wird in der Erdölindustrie zur Entfernung von Schwefelverbindungen aus Rohöl und anderen Kohlenwasserstoffen verwendet.
- Airbag-Gasgeneratoren: Werden bei der Herstellung von Airbag-Gasgeneratoren verwendet, da sie schnell kaputt gehen und Gas erzeugen können.
- Fackeln: Werden aufgrund ihres hohen Sauerstoffgehalts und ihrer Stabilität bei der Herstellung von Fackeln verwendet.
- Metalloberflächenbehandlung: Wird zur Behandlung von Metalloberflächen verwendet, um Rost und andere Verunreinigungen zu entfernen.
- Laboranwendungen: Wird in verschiedenen Laboranwendungen verwendet, beispielsweise bei der Herstellung von Perchlorsäure und als Trocknungsmittel.
Fragen:
F: Wie lautet die Formel für Calciumperchlorat?
A: Ca(ClO4)2.
F: Ist Calciumperchlorat ionisch oder kovalent?
A: Ca(ClO4)2 ist eine ionische Verbindung, da sie aus Calciumkationen (Ca2+) und Perchloratanionen (ClO4-) besteht.
F: Wie entsorge ich Calciumperchlorat?
A: Ca(ClO4)2 kann entfernt werden, indem man den betroffenen Bereich mit Wasser wäscht und anschließend alle verbleibenden Spuren der Verbindung mit einer schwachen Base, wie z. B. Natriumbicarbonat, neutralisiert.
F: Ist Calciumperchlorat löslich?
A: Ja, Ca(ClO4)2 ist in Wasser und anderen polaren Lösungsmitteln löslich. Seine Löslichkeit in Wasser beträgt bei Raumtemperatur etwa 120 g pro 100 ml Wasser.
F: Welche Reaktionen rufen Calciumperchlorat und Wasser hervor?
A: Ca(ClO4)2 und Wasser reagieren unter normalen Bedingungen nicht miteinander.
F: Wie viele Chloratome sind in 0,650 Mol Ca(ClO4)2 enthalten?
A: In 0,650 Mol Ca(ClO4)2 sind 5,88 x 10^23 Chloratome enthalten.
F: Wie groß ist die Molmasse von Ca(ClO4)2?
A: Die Molmasse von Ca(ClO4)2 beträgt 238,98 g/mol.
F: Wie hoch ist der Aktivitätskoeffizient von H in einer Lösung, die 0,073 M HCl und 0,0090 M Ca(ClO4)2 enthält?
A: Der Aktivitätskoeffizient von H in einer Lösung mit 0,073 M HCl und 0,0090 M Ca(ClO4)2 hängt von der Temperatur und anderen Faktoren ab. Sie kann mithilfe thermodynamischer Modelle und experimenteller Daten berechnet werden.
F: Wie viele Mol sind in 26,0 Gramm Ca(ClO4)2 enthalten?
A: In 26,0 Gramm der Verbindung sind 0,109 Mol Ca(ClO4)2 enthalten.
