Calciumnitrit (Ca(NO2)2) ist eine chemische Verbindung, die üblicherweise als Korrosionsinhibitor in Beton verwendet wird. Es hilft, Korrosion von Stahlverstärkungen zu verhindern.
| Name der IUPAC | Calciumdinitrit |
| Molekularformel | Ca(NO2)2 |
| CAS-Nummer | 13780-06-8 |
| Synonyme | Calciumnitrit-Dihydrat, salpetrige Säure, Calciumsalz, Salpetersäure, Calciumsalz, Dihydrat usw. |
| InChI | InChI=1S/Ca.2HNO2/c;2 2-1-3/h;2 (H,2,3) |
Eigenschaften von Calciumnitrit
Calciumnitrit-Formel
Die chemische Formel für Calciumnitrit lautet Ca(NO2)2. Diese Formel gibt an, dass die Verbindung für jedes Calcium-Kation zwei Nitritanionen enthält. Die Formel ist wichtig für die Bestimmung der Zusammensetzung der Verbindung und für die Bestimmung der Menge jedes Elements in der Verbindung.
Molmasse von Calciumnitrit
Die Molmasse von Ca(NO2)2, auch Calciumdinitrit genannt, beträgt etwa 132,09 g/mol. Es ist eine ionische Verbindung, die aus Calciumkationen und Nitritanionen besteht. Die Molmasse wird durch Addition der Atommassen der Bestandteile der Verbindung berechnet, in diesem Fall Kalzium, Stickstoff und Sauerstoff.
Siedepunkt von Calciumnitrit
Ca(NO2)2 hat einen hohen Siedepunkt von etwa 400 °C (752 °F). Dieser hohe Siedepunkt ist auf die starken Ionenbindungen zurückzuführen, die zwischen den Ca2+- und NO2–Ionen in der Verbindung bestehen. Wenn Ca(NO2)2 erhitzt wird, unterliegt es einer thermischen Zersetzung, wobei Stickstoffdioxid und Sauerstoff freigesetzt werden.
Schmelzpunkt von Calciumnitrit
Ca(NO2)2 hat einen Schmelzpunkt von etwa 132 °C (270 °F). Dieser Schmelzpunkt ist im Vergleich zu anderen ionischen Verbindungen, wie beispielsweise Natriumchlorid, das einen Schmelzpunkt von 801 °C (1.474 °F) hat, relativ niedrig. Der niedrige Schmelzpunkt von Ca(NO2)2 kann auf die relativ schwachen Ionenbindungen zurückgeführt werden, die zwischen den Ca2+- und NO2–Ionen bestehen.
Dichte von Calciumnitrit g/ml
Die Dichte von Ca(NO2)2 beträgt etwa 2,32 g/ml. Dieser Wert weist darauf hin, dass Ca(NO2)2 eine relativ dichte Verbindung ist. Die Dichte wird berechnet, indem die Masse der Verbindung durch ihr Volumen dividiert wird. Die hohe Dichte von Ca(NO2)2 kann auf das Vorhandensein relativ schwerer Calciumkationen zurückgeführt werden.
Molekulargewicht von Calciumnitrit
Das Molekulargewicht von Ca(NO2)2 beträgt etwa 132,09 g/mol. Dieser Wert wird durch Addition der Atomgewichte der Bestandteile der Verbindung berechnet. Das Molekulargewicht ist wichtig, um die Menge an Ca(NO2)2 zu bestimmen, die benötigt wird, um eine bestimmte Molzahl der Verbindung zu erhalten.
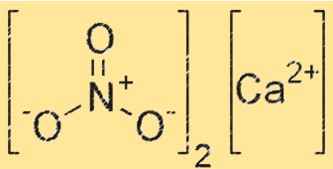
Struktur von Calciumnitrit
Die Struktur von Ca(NO2)2 besteht aus Ca2+ und NO2-. Ca2+-Ionen befinden sich in der Mitte des Kristallgitters, während NO2–Ionen sie umgeben. Das Kristallgitter wird durch starke Ionenbindungen zwischen Ca2+- und NO2–Ionen zusammengehalten.
Löslichkeit von Calciumnitrit
Ca(NO2)2 ist in Wasser und Alkohol löslich. Die Wasserlöslichkeit ist mit einer Löslichkeit von etwa 61 g/100 ml Wasser bei Raumtemperatur relativ hoch. Die Löslichkeit in Alkohol ist geringer als in Wasser. Die Löslichkeit von Ca(NO2)2 ist wichtig für seinen Einsatz in verschiedenen Anwendungen, beispielsweise bei der Betonherstellung.
| Aussehen | Weißes bis leicht gelbes kristallines Pulver oder Feststoff |
| Spezifisches Gewicht | 2.32 |
| Farbe | Farblos bis weiß |
| Geruch | Geruchlos |
| Molmasse | 132,09 g/Mol |
| Dichte | 2,32 g/ml |
| Fusionspunkt | 132 °C (270 °F) |
| Siedepunkt | Zersetzt sich bei etwa 400 °C (752 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Wasser und Alkohol |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Calciumnitrit
Ca(NO2)2 kann schädlich sein, wenn es verschluckt, eingeatmet oder mit der Haut oder den Augen in Berührung kommt. Dies kann zu Reizungen, Verbrennungen und Atemproblemen führen. Die Verbindung ist außerdem ein Oxidationsmittel und kann mit anderen Chemikalien wie Säuren und Metallen unter Bildung gefährlicher Stoffe reagieren. Ca(NO2)2 sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von inkompatiblen Materialien, gelagert werden. Beim Umgang mit der Masse sollte persönliche Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden. Bei Exposition sollte sofort ein Arzt aufgesucht und die kontaminierte Kleidung ausgezogen werden.
| Gefahrensymbole | Xn |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden; persönliche Schutzausrüstung (PSA) tragen; Bei Exposition sofort einen Arzt aufsuchen. |
| UN-Identifikationsnummern | UN 1454 |
| HS-Code | 2834.29.90 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | III |
| Toxizität | Gesundheitsschädlich beim Verschlucken oder Einatmen; kann Reizungen, Verbrennungen und Atemprobleme verursachen |
Methoden zur Calciumnitrit-Synthese
Verschiedene Methoden können Ca(NO2)2 synthetisieren, darunter die Reaktion von Salpetersäure oder Stickoxiden mit Calciumcarbonat , die Reaktion von salpetriger Säure oder Stickoxiden mit Kohlenhydroxid. Calcium und die Reaktion von Calciumhydroxid oder Ammoniumhydroxid mit Calciumnitrat.
Eine übliche Methode ist die Reaktion von Calciumcarbonat mit Salpetersäure zur Herstellung von Calciumnitrat. Dann führt die Reaktion von Calciumnitrat mit Calciumhydroxid zur Bildung von Ca(NO2)2 und Calciumoxid-Nebenprodukten.
Eine andere Methode beinhaltet die Reaktion von Stickoxiden mit Calciumhydroxid zur Herstellung von Ca(NO2)2 und Calciumnitrat.
Bei einer anderen Methode kann man Calciumnitrat mit Calciumhydroxid oder Ammoniumhydroxid reagieren lassen, um Ca(NO2)2 zu erzeugen, während gleichzeitig Calciumnitrat als Nebenprodukt entsteht.
Verwendung von Calciumnitrit
Ca(NO2)2 hat verschiedene Anwendungen in verschiedenen Branchen, darunter:
- Betonindustrie: Wird als Zusatzstoff für Beton verwendet, um die Haltbarkeit und Festigkeit von Betonkonstruktionen zu erhöhen. Es wirkt als Korrosionsinhibitor und schützt Bewehrungsstahl vor Korrosion durch Chloride und andere aggressive Ionen.
- Landwirtschaft: Wird in der Landwirtschaft als Dünger verwendet, um Pflanzen mit Stickstoff und Kalzium zu versorgen. Wird auch als Bodenverbesserungsmittel zur Verbesserung der Bodenqualität und zur Förderung des Pflanzenwachstums verwendet.
- Chemische Industrie: Wird als Reduktionsmittel bei chemischen Reaktionen sowie als Vorstufe für die Synthese anderer Chemikalien wie Calciumnitrat und Calciumammoniumnitrat verwendet.
- Abwasserbehandlung: Wird als Abwasserbehandlungschemikalie verwendet, um Verunreinigungen zu entfernen und die Konzentration schädlicher Substanzen im Wasser zu reduzieren.
- Lebensmittelindustrie: Wird als Lebensmittelkonservierungsmittel verwendet, um das Wachstum von Bakterien und anderen Mikroorganismen in Fleisch, Fisch und anderen Lebensmitteln zu verhindern.
Fragen:
F: Wie lautet die Formel für Calciumnitrit?
A: Die chemische Formel für Calciumnitrit lautet Ca(NO2)2.
F: Wie viel Calciumnitrit wird jedes Jahr in Beton verwendet?
A: Die Menge an Ca(NO2)2, die jedes Jahr in Beton verwendet wird, variiert je nach spezifischer Anwendung und Marktnachfrage. Es wird jedoch geschätzt, dass weltweit jedes Jahr mehrere tausend Tonnen Ca(NO2)2 als Betonzusatzstoff verwendet werden.
F: Ist Calciumnitrit wasserlöslich?
A: Ja, Ca(NO2)2 ist wasserlöslich. Es hat eine Löslichkeit von etwa 167 g/L bei 20 °C.
F: Ist Calciumnitrit ein Salz?
A: Ja, Ca(NO2)2 ist Salz. Eine ionische Verbindung bestehend aus Calciumkationen (Ca2+) und Nitritanionen (NO2-).
F: Wie würden die folgenden Lösungen vorbereitet? 1,25 l einer 0,775 m Lösung von Ca(NO2)2
A: Um 1,25 l einer 0,775 M Lösung von Ca(NO2)2 herzustellen, müssten Sie etwa 187,5 g Ca(NO2)2 in ausreichend Wasser auflösen, um ein Endvolumen von 1,25 l zu erhalten. Dies kann mit berechnet werden Formelformel: Gramm gelöster Stoff = Molarität x Volumen (in Liter) x Molmasse des gelösten Stoffes.
F: Wie lautet die Ionenverbindungsformel für Calciumnitrit?
A: Die ionische Verbindungsformel für Ca(NO2)2 ist Ca(NO2)2. Es besteht aus einem Calciumion (Ca2+) und zwei Nitritionen (NO2-).
