Calciumiodid (CaI2) ist eine chemische Verbindung aus Calcium und Jod. Es wird häufig als Jodzusatz und in der Fotografie als fotografischer Verstärker verwendet.
| Name der IUPAC | Calciumjodid |
| Molekularformel | CaI2 |
| CAS-Nummer | 10102-68-8 |
| Synonyme | Calciumdiiodid, Calcii iodidum, Calciumiodid |
| InChI | InChI=1S/Ca.2HI/h;2*1H/q+2;;/p-2 |
Eigenschaften von Calciumjodid
Calciumjodid-Formel
Die chemische Formel für Calciumiodid lautet CaI2. Dies weist darauf hin, dass auf jedes Calciumatom in der Verbindung zwei Jodatome kommen. Calciumiodid ist ein weißer kristalliner Feststoff, der in Wasser und anderen polaren Lösungsmitteln gut löslich ist. Es wird häufig als Jodquelle in Tierfutter und als Bestandteil fotografischer Verstärker verwendet.
Molmasse von Calciumiodid
CaI2 hat eine Molmasse von etwa 293,89 g/mol. Dies wird berechnet, indem die Atommassen von Ca (40,08 g/mol) und I (126,9 g/mol) mal zwei addiert werden, da es in CaI2 zwei I-Atome gibt. Die Molmasse einer Verbindung ist eine wichtige Eigenschaft für stöchiometrische Berechnungen, bei denen die Menge der benötigten Reaktanten oder die Menge der bei einer chemischen Reaktion erzeugten Produkte bestimmt wird.
Siedepunkt von Calciumiodid
Der Siedepunkt von CaI2 liegt bei etwa 1,327 °C (2,421 °F). Dieser hohe Siedepunkt ist auf die starke Ionenbindung zwischen den Calcium- und Jodatomen der Verbindung zurückzuführen. CaI2 wird häufig in Hochtemperaturanwendungen verwendet, beispielsweise bei der Herstellung von Legierungen und Keramik.
Schmelzpunkt von Calciumiodid
CaI2 hat einen Schmelzpunkt von etwa 779 °C (1.434 °F). Der hohe Schmelzpunkt von CaI2 ist auf die starke Ionenbindung zwischen den Ca- und I-Atomen der Verbindung zurückzuführen. CaI2 wird häufig in Hochtemperaturanwendungen eingesetzt, beispielsweise bei der Herstellung geschmolzener Salze und als Wärmeübertragungsflüssigkeit.
Dichte von Calciumiodid g/ml
Die Dichte von CaI2 beträgt etwa 4,51 g/ml. Diese hohe Dichte ist auf das Vorhandensein von zwei I-Atomen pro Ca-Atom in der Verbindung zurückzuführen. CaI2 wird häufig als Jodquelle in Tierfutter und als Bestandteil fotografischer Verstärker verwendet.
Molekulargewicht von Calciumiodid
Das Molekulargewicht von CaI2 beträgt etwa 293,89 g/mol. Dies wird berechnet, indem die Atommassen von Ca und I addiert und mit zwei multipliziert werden, da die Verbindung zwei I-Atome enthält. Das Molekulargewicht einer Verbindung ist eine wichtige Eigenschaft für stöchiometrische Berechnungen, bei denen die Menge der benötigten Reaktanten oder die Menge der bei einer chemischen Reaktion erzeugten Produkte bestimmt wird.
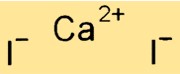
Struktur von Calciumiodid
CaI2 hat eine ähnliche Kristallstruktur wie Natriumchlorid (NaCl). Es bildet ein flächenzentriertes kubisches Gitter, wobei Ca+2-Ionen die Ecken des Würfels und I–Ionen die Mittelpunkte der Flächen besetzen. Die starken ionischen Bindungen zwischen den Ca- und I-Atomen in der Verbindung verleihen ihr einen hohen Schmelz- und Siedepunkt.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 4.51 |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 293,89 g/Mol |
| Dichte | 4,51 g/ml |
| Fusionspunkt | 779 °C (1.434 °F) |
| Siedepunkt | 1.327 °C (2.421 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Ethanol und Aceton |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Calciumjodid
CaI2 gilt im Allgemeinen als sicher und ungiftig, wenn es richtig gehandhabt und verwendet wird. Allerdings kann es bei Kontakt zu Haut, Augen und Atemwegen reizen. Das Einatmen von CaI2-Staub kann zu Reizungen der Lunge und des Rachens führen. Beim Umgang mit CaI2 ist es wichtig, geeignete persönliche Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske zu tragen. CaI2 gilt nicht als brennbar oder explosiv und es ist nicht bekannt, dass es krebserregend oder mutagen ist. Es ist wichtig, die richtigen Handhabungs- und Lagerungsverfahren einzuhalten, um mögliche Gefahren zu minimieren.
| Gefahrensymbole | Xn,N |
| Sicherheitsbeschreibung | 26-36/37/39-45-61 |
| UN-Identifikationsnummern | UN3077 |
| HS-Code | 28276000 |
| Gefahrenklasse | 9 |
| Verpackungsgruppe | III |
| Toxizität | Kann reizend wirken, beim Verschlucken oder Einatmen gesundheitsschädlich sein und bei längerer oder wiederholter Exposition zu Organschäden führen. |
Methoden zur Synthese von Calciumiodid
Die gebräuchlichste Methode zur Synthese von CaI2 ist die Reaktion von Jodwasserstoffsäure oder Jod mit Calciumcarbonat oder Calciumhydroxid.
Reagieren Sie Calciumcarbonat oder Calciumhydroxid mit Jodwasserstoffsäure oder Jod, um CaI2 zu synthetisieren.
Die zweite Methode beinhaltet die Reaktion von Calciumoxid mit Jod, um CaI2 und Sauerstoffgas zu erzeugen. Anstelle von Calciumoxid kann auch Calciumhydroxid diese Reaktion durchführen.
Eine andere Methode zur Herstellung von CaI2 beinhaltet die Reaktion von metallischem Calcium mit Jod. Calcium reagiert mit Jod unter Bildung von CaI2 und setzt Wärme frei. Calciumhydrid ersetzt das metallische Calcium bei der Reaktion zur Herstellung von CaI2.
Die Reaktion von Calcium mit Jodwasserstoffsäure in Gegenwart eines Reduktionsmittels wie Eisen oder Zink erzeugt CaI2. Verdampfen Sie die Lösung, um CaI2-Kristalle zu erhalten.
Verwendung von Calciumjodid
CaI2 hat verschiedene Anwendungen in verschiedenen Branchen, darunter:
- Medizinisch: Wird als Jodquelle für Nahrungsergänzungsmittel und Arzneimittel wie Schilddrüsenhormone und Radiopharmazeutika verwendet.
- Chemische Synthese: Wird als Katalysator in mehreren chemischen Reaktionen verwendet, einschließlich der Umwandlung von Alkoholen in Alkyliodide und der Dehydratisierung primärer Amide zu Nitrilen.
- Fotografie: Wird bei der Herstellung von Fotofilmen und -papieren als Sensibilisator für Silberbromid und Silberchlorid verwendet.
- Elektronik: wird bei der Herstellung von Halbleitern, Szintillationsdetektoren und Strahlungsschilden verwendet.
- Lebensmittelindustrie: Wird als Zusatzstoff in der Lebensmittelindustrie verwendet, um eine Jodquelle für die Lebensmittelanreicherung bereitzustellen.
- Tierfutter: Wird als Ergänzung zu Tierfutter verwendet, um Jodmangel vorzubeugen und die Tiergesundheit zu verbessern.
- Öl- und Gasindustrie: Wird auch als Bohrflüssigkeitszusatz in der Öl- und Gasindustrie verwendet, um Schieferformationen zu stabilisieren und den Einsturz von Bohrlöchern zu verhindern.
Fragen:
F: Welches Volumen einer 0,120 M CaI2-Lösung würde 0,078 Mol gelösten Stoff enthalten?
A: Um das Volumen der CaI2-Lösung mit 0,078 Mol gelöstem Stoff zu berechnen, können wir die Formel verwenden: Mol = Konzentration x Volumen. Wenn wir diese Formel umstellen, um sie nach dem Volumen aufzulösen, erhalten wir Volumen = Mol/Konzentration. Wenn wir die in der Frage angegebenen Werte ersetzen, erhalten wir Volumen = 0,078 mol / 0,120 M = 0,65 l. Daher beträgt das Volumen der CaI2-Lösung, die 0,078 mol gelösten Stoff enthält, 0,65 l.
F: Ist CaI2 wasserlöslich?
A: Ja, CaI2 ist in Wasser gut löslich, mit einer Löslichkeit von 121 g/100 ml bei 20 °C.
F: Wie heißt die Verbindung mit der Formel CaI2?
A: Die Verbindung mit der Formel CaI2 heißt Calciumiodid.
F: Was ist CaI2?
A: CaI2 ist eine chemische Verbindung bestehend aus Kalzium und Jod. Es ist ein weißer oder farbloser kristalliner Feststoff, der in Wasser gut löslich ist.
F: Welche Reaktion findet an der Anode während der Elektrolyse von CaI2 statt?
A: Bei der Elektrolyse von CaI2 beinhaltet die anodische Reaktion die Oxidation von I-Ionen unter Bildung von Jodgas und Elektronen. Die Gesamtreaktion ist: 2I- -> I2 + 2e-.
F: Wie lautet die Formel für Calciumjodid?
A: Die Formel für Calciumiodid lautet CaI2.
F: Ist CaI2 ionisch oder kovalent?
A: CaI2 ist eine ionische Verbindung, die aus einem metallischen Kation (Ca2+) und einem nichtmetallischen Anion (I-) besteht.
