Calciumchlorat (Ca(ClO3)2) ist eine chemische Verbindung bestehend aus Calcium, Chlor und Sauerstoff. Es wird häufig als Oxidationsmittel in Feuerwerkskörpern und Streichhölzern verwendet. Es kann auch zur Sterilisation von Geräten in der Lebensmittelindustrie verwendet werden.
| IUPAC-Name | Calciumchlorat |
| Molekularformel | Ca(ClO3)2 |
| CAS-Nummer | 10137-74-3 |
| Synonyme | Chlorsäure, Calciumsalz; Hydratisiertes Calciumchlorat; Calciumperchlorat; Calciochlorit; UN1456 |
| InChI | InChI=1S/Ca.2ClHO3/c;2 2-1(3)4/h;2 (H,2,3,4)/q+2;;/p-2 |
Eigenschaften von Calciumchlorat
Calciumchlorat-Formel
Die Formel für Calciumchlorat lautet Ca(ClO3)2. Es besteht aus einem Ca2+-Ion und zwei ClO3–Ionen. Calciumchlorat ist eine ionische Verbindung, das heißt, es wird durch elektrostatische Anziehung zwischen positiven und negativen Ionen zusammengehalten.
Molmasse von Calciumchlorat
Die Molmasse von Ca(ClO3)2 beträgt 206,98 g/mol. Dies kann durch Addition der Atommassen von Kalzium, Chlor und Sauerstoff berechnet werden, aus denen die Verbindung besteht. Die Molmasse ist wichtig für die Berechnung der Menge an Ca(ClO3)2, die für eine bestimmte Reaktion benötigt wird.
Siedepunkt von Calciumchlorat
Ca(ClO3)2 hat keinen Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Beim Erhitzen zerfällt Ca(ClO3)2 in Calciumchlorid (CaCl2) und Sauerstoffgas (O2). Diese Zersetzung ist exotherm und kann bei unsachgemäßer Handhabung gefährlich sein.
Calciumchlorat Schmelzpunkt
Der Schmelzpunkt von Ca(ClO3)2 beträgt 135°C. Dies ist die Temperatur, bei der die feste Verbindung vom festen in den flüssigen Zustand übergeht. Ca(ClO3)2 ist bei Raumtemperatur und -druck ein weißer kristalliner Feststoff.
Dichte von Calciumchlorat g/ml
Die Dichte von Ca(ClO3)2 beträgt 2,4 g/ml. Das bedeutet, dass ein Milliliter Ca(ClO3)2 2,4 Gramm wiegt. Die Dichte ist ein Maß für die Dichte von Molekülen in einer Substanz. Ca(ClO3)2 ist dichter als Wasser, das eine Dichte von 1 g/ml hat.
Molekulargewicht von Calciumchlorat
Das Molekulargewicht von Ca(ClO3)2 beträgt 206,98 g/mol. Sie entspricht der Molmasse und kann durch Addition der Atomgewichte der einzelnen Elemente in der Verbindung berechnet werden.
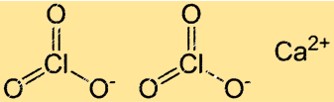
Struktur von Calciumchlorat
Ca(ClO3)2 hat eine für ionische Verbindungen typische Kristallgitterstruktur. In dieser Struktur sind die Ca2+- und ClO3–Ionen in einem regelmäßigen, sich wiederholenden Muster angeordnet. Jedes Ca2+-Ion ist von sechs ClO3–Ionen umgeben und jedes Chloration ist von sechs Calciumionen umgeben.
Löslichkeit von Calciumchlorat
Ca(ClO3)2 ist wasserlöslich und bildet eine klare, farblose Lösung. Die Löslichkeit von Ca(ClO3)2 in Wasser steigt mit der Temperatur. Allerdings ist es in organischen Lösungsmitteln wie Ethanol und Aceton weniger löslich. Ca(ClO3)2 ist außerdem hygroskopisch, d. h. es nimmt Feuchtigkeit aus der Luft auf. Dies kann dazu führen, dass die Verbindung mit der Zeit nass wird oder sich auflöst.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2.4 |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 206,98 g/Mol |
| Dichte | 2,4 g/ml |
| Fusionspunkt | 135°C |
| Siedepunkt | Zersetzt sich vor dem Siedepunkt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Wasser, weniger löslich in organischen Lösungsmitteln |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Calciumchlorat
Ca(ClO3)2 gilt als Gefahrstoff und sollte mit Vorsicht gehandhabt werden. Es ist ein Oxidationsmittel, das heftig mit organischen Materialien reagieren und Brände und Explosionen verursachen kann. Das Einatmen oder Verschlucken von Ca(ClO3)2 kann zu Reizungen der Atemwege und des Magen-Darm-Trakts führen. Längerer Kontakt kann zu Hautreizungen, Verbrennungen und möglichen allergischen Reaktionen führen. Beim Umgang mit Ca(ClO3)2 ist es wichtig, geeignete persönliche Schutzausrüstung zu tragen, einschließlich Handschuhen, Schutzbrille und Atemschutzmaske. Bei Exposition sofort einen Arzt aufsuchen. Lagern Sie Ca(ClO3)2 an einem kühlen, trockenen und gut belüfteten Ort, entfernt von unverträglichen Substanzen.
| Gefahrensymbole | O, Xn |
| Sicherheitsbeschreibung | Von organischen Materialien fernhalten. Tragen Sie persönliche Schutzausrüstung. An einem kühlen, trockenen und gut belüfteten Ort aufbewahren. |
| UN-Identifikationsnummern | UN1458 |
| HS-Code | 2829.11.00 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Giftig bei Verschlucken oder Einatmen. Kann Haut- und Augenreizungen verursachen. Kann Reizungen der Atemwege verursachen. |
Methoden zur Calciumchlorat-Synthese
Um Ca(ClO3)2 zu synthetisieren, können wir verschiedene Methoden anwenden.
Eine übliche Methode beinhaltet die Reaktion von Calciumhydroxid mit Chlorgas. Bei diesem Prozess entsteht zunächst Calciumchlorid als Nebenprodukt, das mit dem restlichen Chlor zu Ca(ClO3)2 reagiert.
Eine andere Methode beinhaltet die Reaktion von Calciumcarbonat mit Salpetersäure und Chlorgas. Zur Gewinnung von Ca(ClO3)2 wird die erhaltene Lösung eingedampft und kristallisiert.
Ein anderer Ansatz beinhaltet die Elektrolyse einer Lösung, die Calciumchlorid und Natriumchlorat enthält. Als Endprodukte entstehen bei diesem Prozess Ca(ClO3)2 und Natriumchlorid.
Bei der Reaktion zwischen Calciumhypochlorit und Natriumchlorat entsteht Ca(ClO3)2, das dann gereinigt und kristallisiert wird.
Verwendung von Calciumchlorat
Ca(ClO3)2 hat mehrere wichtige Anwendungen in verschiedenen Branchen. Hier sind einige der häufigsten Anwendungen von Ca(ClO3)2:
- Bleichmittel: Wird als Bleichmittel in der Zellstoff- und Papierindustrie verwendet.
- Feuerwerkskörper: Ein Oxidationsmittel, das üblicherweise bei der Herstellung von Feuerwerkskörpern verwendet wird.
- Streichhölzer: Wird auch bei der Herstellung von Sicherheitsstreichhölzern verwendet, da diese sich leicht entzünden lassen.
- Herbizide: Wird als Herbizid verwendet, da es bestimmte Unkräuter selektiv abtöten kann, ohne die Nutzpflanzen zu schädigen.
- Oxidationsmittel: Wird als Oxidationsmittel bei der Herstellung anderer Chemikalien wie Perchloraten und Chloraten verwendet.
- Pharmazeutika: Wird auch bei der Herstellung pharmazeutischer Produkte wie Antiinfektiva verwendet.
- Laborreagenz: Wird als Laborreagenz für die analytische Chemie verwendet.
- Pigmentproduktion: Wird zur Herstellung von Pigmenten wie Ultramarinblau verwendet.
Fragen:
F: Wie lautet die Formel für Calciumchlorat?
A: Die chemische Formel für Calciumchlorat lautet Ca(ClO3)2.
F: Wofür wird Calciumchlorat verwendet?
A: Ca(ClO3)2 hat verschiedene Anwendungen in der Industrie, beispielsweise als Bleichmittel in der Zellstoff- und Papierindustrie, als Oxidationsmittel bei der Herstellung anderer Chemikalien, Herbizide, Produktionspigmente und Laborreagenzien.
F: Ist Calciumchlorat ein Feststoff?
A: Ja, Ca(ClO3)2 ist bei Raumtemperatur ein Feststoff.
F: Wo kommt Natriumchlorat am häufigsten vor und wofür wird Calciumchlorat verwendet?
A: Natriumchlorat kommt am häufigsten in der chemischen Industrie vor, wo es als Oxidationsmittel und Herbizid eingesetzt wird. Ca(ClO3)2 hingegen wird in verschiedenen Industrien als Bleichmittel, Oxidationsmittel und Herbizid eingesetzt.
F: Wie viele Atome hat die Verbindung Ca(ClO3)2 insgesamt?
A: Die Verbindung Ca(ClO3)2 hat insgesamt 13 Atome: 1 Calciumatom, 2 Chloratome und 6 Sauerstoffatome aus den beiden ClO3-Ionen.
F: Wie hoch ist der Massenanteil von Chlor in Ca(ClO3)2?
A: Die Atommasse von Chlor beträgt 35,5 g/mol und die Molmasse von Ca(ClO3)2 beträgt 238,98 g/mol. Daher beträgt der Massenanteil von Chlor in Ca(ClO3)2 (2 x 35,5 g/mol) / 238,98 g/mol x 100 % = 29,68 %.
F: Wie viele Chloratome gibt es in Ca(ClO3)2?
A: Es gibt zwei Chloratome in Ca(ClO3)2, dargestellt durch die beiden ClO3-Gruppen.
F: Wie groß ist die Masse jeder Verbindung in der ursprünglichen Ca(ClO3)2- und Ca(ClO)2-Mischung?
A: Ohne zusätzliche Informationen wie die Gesamtmasse oder das Massenverhältnis zwischen den beiden Verbindungen ist es unmöglich, die Masse jeder Verbindung in der Originalmischung zu bestimmen.
