Calciumcarbonat ist eine chemische Verbindung mit der Formel CaCO3. Es kommt häufig in Gesteinen und Muscheln vor und wird bei der Herstellung von Zement, Farben und Nahrungsergänzungsmitteln verwendet.
| IUPAC-Name | Kalziumkarbonat |
| Molekularformel | CaCO3 |
| CAS-Nummer | 471-34-1 |
| Synonyme | Kalkstein, Kreide, Calcit, Aragonit, Marmor, gefälltes Calciumcarbonat, Calciumsalz der Kohlensäure (1:1) |
| InChI | InChI=1S/CH2O3.Ca/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
CaCO3 Molmasse
Die Molmasse von Calciumcarbonat beträgt 100,09 g/mol. Das bedeutet, dass ein Mol Calciumcarbonat 100,09 Gramm der Verbindung enthält. Die Molmasse ist bei stöchiometrischen Berechnungen wichtig, da sie die Umrechnung von Mol in Gramm oder umgekehrt ermöglicht.
Calciumcarbonat-Formel
Die chemische Formel für Calciumcarbonat lautet CaCO₃. Das bedeutet, dass jedes Calciumcarbonat-Molekül ein Calciumatom, ein Kohlenstoffatom und drei Sauerstoffatome enthält. Die Formel ist wichtig, um die Menge an Calciumcarbonat zu bestimmen, die für eine bestimmte Anwendung benötigt wird, und um seine chemischen Eigenschaften zu verstehen.
Siedepunkt von Calciumcarbonat
Calciumcarbonat hat keinen Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Bei Atmosphärendruck zerfällt Calciumcarbonat bei Temperaturen über 825 °C in Calciumoxid und Kohlendioxid. Daher wird Calciumcarbonat häufig in Hochtemperaturanwendungen verwendet, beispielsweise in der Zementherstellung.
Schmelzpunkt von Calciumcarbonat
Der Schmelzpunkt von Calciumcarbonat liegt bei 1339°C. Bei dieser Temperatur zersetzt sich Calciumcarbonat thermisch zu Calciumoxid und Kohlendioxid. Der Schmelzpunkt ist wichtig für das Verständnis des Verhaltens von Calciumcarbonat bei hohen Temperaturen.
Dichte von Calciumcarbonat g/ml
Die Dichte von Calciumcarbonat beträgt 2,71 g/cm³. Das bedeutet, dass Calciumcarbonat eine höhere Dichte als Wasser hat und beim Eintauchen in Wasser sinkt. Die Dichte ist wichtig für das Verständnis der physikalischen Eigenschaften von Calciumcarbonat und für die Bestimmung seiner Verwendung in verschiedenen Anwendungen.
Molekulargewicht von Calciumcarbonat
Das Molekulargewicht von Calciumcarbonat beträgt 100,09 g/mol. Das bedeutet, dass die Verbindung aus einem Calciumatom, einem Kohlenstoffatom und drei Sauerstoffatomen besteht. Das Molekulargewicht ist wichtig, um die Menge an Calciumcarbonat zu bestimmen, die für eine bestimmte Anwendung benötigt wird, und um seine chemischen Eigenschaften zu verstehen.
Struktur von Calciumcarbonat
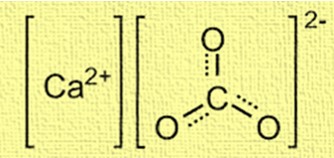
Die Struktur von Calciumcarbonat ist kristallin und besteht aus Calciumionen (Ca²⁺) und Carbonationen (CO₃²⁻). Calciumionen befinden sich im Zentrum der Struktur und sind von sechs Carbonationen umgeben. Die Carbonationen sind trigonal-planar angeordnet, wobei jedes Sauerstoffatom durch eine Doppelbindung mit dem Kohlenstoffatom verbunden ist. Die Struktur ist wichtig für das Verständnis des Verhaltens von Calciumcarbonat in verschiedenen Anwendungen, beispielsweise bei der Bildung von Muscheln und Korallenriffen.
| Aussehen | Weißes Pulver oder farbloser Kristall |
| Spezifisches Gewicht | 2,71 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 100,09 g/Mol |
| Dichte | 2,71 g/cm³ |
| Fusionspunkt | 1339°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 0,0013 g/100 ml (25°C) |
| Löslichkeit | Unlöslich in Wasser und den meisten organischen Lösungsmitteln |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | 9:00 Uhr (zuerst); 11,8 (Sekunde) |
| pH-Wert | 9,3 – 9,7 (0,1 M wässrige Lösung) |
Sicherheit und Gefahren von Calciumcarbonat
Bei bestimmungsgemäßer Verwendung gilt Calciumcarbonat im Allgemeinen als sicher für Mensch und Umwelt. Das Einatmen von Calciumcarbonatstaub kann jedoch zu Reizungen der Atemwege, Augen und Haut führen. Eine langfristige Exposition gegenüber hohen Konzentrationen von Kalziumkarbonatstaub kann zu Lungenschäden führen. Calciumcarbonat kann auch mit starken Säuren unter Bildung von Kohlendioxid reagieren, was in bestimmten Situationen zu Brand- oder Explosionsgefahr führen kann. Beim Umgang mit Kalziumkarbonat ist es wichtig, die richtigen Sicherheitsmaßnahmen einzuhalten, wie z. B. das Tragen von Schutzausrüstung und die Gewährleistung einer ausreichenden Belüftung.
| Gefahrensymbole | Unzutreffend |
| Sicherheitsbeschreibung | Einatmen von Staub vermeiden. Schutzausrüstung tragen. |
| UN-Identifikationsnummern | Nicht reguliert |
| HS-Code | 2836.50.00 |
| Gefahrenklasse | Nicht reguliert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität für Mensch und Umwelt |
Methoden zur Calciumcarbonat-Synthese
Verschiedene Methoden können Calciumcarbonat (CaCo3) synthetisieren, darunter Fällungs-, Karbonisierungs- und Sol-Gel-Methoden.
Bei der Fällungsmethode wird Calciumhydroxid mit einem löslichen Carbonatsalz wie Natriumcarbonat unter kontrollierten Bedingungen gemischt, um einen CaCo3-Niederschlag zu bilden. Um das Endprodukt zu erhalten, muss der Niederschlag filtriert und getrocknet werden.
Bei der Karbonisierungsmethode wird Calciumoxid mit Kohlendioxid unter hohem Druck und hoher Temperatur umgesetzt, um CaCo3 zu erzeugen. Die Reaktion muss in einem geschlossenen System durchgeführt werden, um den Austritt von Kohlendioxid zu verhindern. Als nächstes muss jegliches nicht umgesetztes Calciumoxid oder Kohlendioxid vom resultierenden CaCo3 abgetrennt und gereinigt werden.
Bei der Sol-Gel-Methode erfolgt die Hydrolyse und Kondensation eines kalziumhaltigen Vorläufers wie Kalziumalkoxid oder Kalziumnitrat in Gegenwart eines Lösungsmittels und eines Katalysators. Zur Herstellung von CaCo3 muss das erhaltene Gel getrocknet und kalziniert werden.
Bei der CaCo3-Synthesemethode kommt die Biomineralisierung zum Einsatz, bei der lebende Organismen wie Korallen oder Austernschalen CaCo3-Kristalle erzeugen. Die Betreiber sammeln diese Kristalle und verarbeiten sie, um das Endprodukt zu erhalten.
Jede Methode hat ihre eigenen Vor- und Nachteile und die Wahl der Methode hängt von Faktoren wie Kosten, Reinheit und gewünschter Partikelgröße des Endprodukts ab.
Verwendung von Calciumcarbonat
Aufgrund seiner Eigenschaften wie geringer Toxizität, hoher Reinheit und kostengünstiger Verfügbarkeit findet Calciumcarbonat vielfältige Verwendungsmöglichkeiten in verschiedenen Branchen. Einige häufige Anwendungen von Calciumcarbonat sind:
- Bau: Wird als Baumaterial in Form von Kalkstein, Marmor und Kreide verwendet. Wird als Füllstoff zur Verbesserung der Festigkeit und Haltbarkeit von Zement, Mörtel und Beton verwendet.
- Pharmazeutika: werden zur Herstellung von Antazida und Kalziumpräparaten verwendet. Wird als Hilfsstoff bei der Formulierung von Tabletten und Kapseln verwendet.
- Lebensmittel und Getränke: Wird als Lebensmittelzusatzstoff zur Anreicherung von Kalzium und als pH-Regler in Getränken verwendet.
- Papier und Zellstoff: Wird als Füllstoff und Beschichtungsmittel bei der Herstellung von Papier und Karton verwendet, um die Bedruckbarkeit und den Weißgrad zu verbessern.
- Kunststoffe: Wird als Füllstoff und Verstärkung in Kunststoffprodukten verwendet, um deren mechanische Eigenschaften zu verbessern und Kosten zu senken.
- Farben und Beschichtungen: Wird als Pigment und Füllstoff in Farben und Beschichtungen verwendet, um deren Deckkraft und Deckkraft zu verbessern.
- Landwirtschaft: Wird als Bodenverbesserungsmittel zur Verbesserung der Bodenqualität und des Pflanzenwachstums verwendet.
- Wasseraufbereitung: Wird verwendet, um saures Wasser zu neutralisieren und Verunreinigungen aus dem Wasser zu entfernen.
Dies sind einige der häufigsten Verwendungszwecke für Calciumcarbonat, es gibt jedoch noch viele andere Anwendungen in verschiedenen Branchen.
Fragen:
F: Ist Calciumcarbonat wasserlöslich?
A: Calciumcarbonat hat eine geringe Wasserlöslichkeit, mit einer Löslichkeit von etwa 0,0013 g/100 ml bei 25 °C.
F: Was ist Calciumcarbonat?
A: Calciumcarbonat ist eine chemische Verbindung mit der Formel CaCO3. Es ist eine häufig vorkommende Substanz, die in Gesteinen, Muscheln von Meeresorganismen und in verschiedenen Mineralvorkommen vorkommt.
F: Wo gibt es Calciumcarbonat?
A: Calciumcarbonat kommt in verschiedenen natürlichen Quellen wie Kalkstein, Kreide und Marmor vor. Es kommt auch in den Schalen von Meeresorganismen wie Austern, Muscheln und Korallen vor.
F: Ist Calciumcarbonat ionisch oder kovalent?
A: Calciumcarbonat ist eine ionische Verbindung, die aus einem Calciumkation (Ca2+) und einem Carbonatanion (CO32-) besteht.
F: Calciumcarbonat ist eine Art hydriertes Sediment, das vergraben und zu _____ ausgehärtet werden kann.
A: Calciumcarbonat ist eine Art hydriertes Sediment, das vergraben und zu Kalkstein ausgehärtet werden kann.
F: Die von präkambrischen Cyanobakterien aus Kalziumkarbonat gebildeten Schichtstrukturen werden _____ genannt.
A: Die von präkambrischen Cyanobakterien aus Kalziumkarbonat gebildeten Schichtstrukturen werden Stromatolithen genannt.
