Calciumbisulfit (Ca(HSO3)2) ist eine Verbindung aus Calcium, Schwefel und Sauerstoff. Es wird häufig als Lebensmittelkonservierungsmittel und Antioxidans in der Lebensmittelindustrie verwendet.
| IUPAC-Name | Calciumhydrogensulfit |
| Molekularformel | Ca(HSO3)2 |
| CAS-Nummer | 13780-03-5 |
| Synonyme | Calciumbisulfit, Calciumhydrogensulfit, Calciumschweflige Säure, Kalkbisulfit |
| InChI | InChI=1S/Ca.2H2O3S/c;2*1-4(2)3/h;(H2,1,2,3)/q+2;;/p-2 |
Eigenschaften von Calciumbisulfit
Calciumbisulfit-Formel
Die chemische Formel für Calciumbisulfit lautet Ca(HSO3)2. Es gibt die Anzahl und Art der Atome in einem Molekül oder einer Formeleinheit an. Die Formel ist wichtig für die Bestimmung des Molekulargewichts, der Molmasse und anderer Eigenschaften der Verbindung. Ca(HSO3)2 ist eine wichtige Verbindung, die in der Lebensmittelindustrie als Konservierungsmittel und Antioxidans verwendet wird.
Molmasse von Calciumbisulfit
Ca(HSO3)2 hat eine Molmasse von 202,2 g/mol. Es ist eine ionische Verbindung bestehend aus Calcium, Hydrogensulfit und Schwefeldioxid. Die Molmasse ist wichtig für die Berechnung der Menge an Ca(HSO3)2, die in einer Reaktion benötigt wird, oder für die Herstellung einer Lösung einer gewünschten Konzentration.
Siedepunkt von Calciumbisulfit
Der Siedepunkt von Ca(HSO3)2 ist kein genau definierter Wert, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Ca(HSO3)2 zersetzt sich unter Freisetzung von Schwefeldioxid. Daher wird es nicht in Prozessen verwendet, die Hochtemperaturanwendungen erfordern.
Schmelzpunkt von Calciumbisulfit
Der Schmelzpunkt von Ca(HSO3)2 beträgt 203°C. Bei dieser Temperatur zersetzt es sich zu Calciumsulfat und Schwefeldioxid. Die Zersetzung von Ca(HSO3)2 ist eine exotherme Reaktion und erzeugt große Mengen Wärme. Daher muss beim Erhitzen vorsichtig damit umgegangen werden.
Dichte von Calciumbisulfit g/ml
Die Dichte von Ca(HSO3)2 variiert je nach der Form, in der es vorkommt. Die wasserfreie Form von Ca(HSO3)2 hat eine Dichte von 2,68 g/ml, während die Dihydratform eine Dichte von 1,98 g/ml hat. Die Dichte einer Substanz ist wichtig, um zu bestimmen, wie viel Substanz benötigt wird, um ein bestimmtes Volumen zu füllen.
Molekulargewicht von Calciumbisulfit
Das Molekulargewicht von Ca(HSO3)2 beträgt 202,2 g/mol. Sie wird durch Addition der Atomgewichte der Grundelemente berechnet: Calcium (40,08 g/mol), Wasserstoff (1,008 g/mol), Schwefel (32,06 g/mol) und Sauerstoff (15,99 g/mol). Das Molekulargewicht ist wichtig für die Bestimmung der Stoffmenge, die für eine Reaktion benötigt wird.
Struktur von Calciumbisulfit
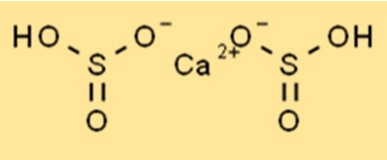
Die Struktur von Ca(HSO3)2 ist eine ionische Verbindung mit der chemischen Formel Ca(HSO3)2. Es hat eine tetraedrische Form mit einem zentralen Calciumatom, das von vier Sauerstoffatomen umgeben ist. Wasserstoffsulfit-Ionen sind durch ionische Bindungen an das Calciumatom gebunden. Die Struktur von Ca(HSO3)2 ist wichtig für das Verständnis seiner chemischen Eigenschaften.
Löslichkeit von Calciumbisulfit
Ca(HSO3)2 ist in Wasser mäßig löslich, mit einer Löslichkeit von etwa 60 Gramm pro 100 Milliliter Wasser bei Raumtemperatur. Seine Löslichkeit nimmt mit der Temperatur zu und es ist auch in Ethanol und Glycerin löslich.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 2,68 (wasserfrei), 1,98 (Dihydrat) |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 202,2 g/Mol |
| Dichte | 2,68 g/ml (wasserfrei), 1,98 g/ml (Dihydrat) |
| Fusionspunkt | 203°C |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Wasser, unlöslich in organischen Lösungsmitteln |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 1,92 |
| pH-Wert | 4,5-6,0 |
Sicherheit und Gefahren von Calciumbisulfit
Ca(HSO3)2 gilt im Allgemeinen als sicher, wenn es in kleinen Mengen in Lebensmitteln verwendet wird. Bei unsachgemäßer Handhabung kann es jedoch gefährlich sein. Beim Einatmen kann es zu Hautreizungen, Augenreizungen und Atemwegserkrankungen kommen. Die Einnahme großer Mengen kann zu Magen-Darm-Beschwerden, einschließlich Übelkeit und Erbrechen, führen. Ca(HSO3)2 sollte mit Vorsicht gehandhabt werden und bei der Arbeit sollte Schutzausrüstung wie Handschuhe und Atemschutzmaske getragen werden. Es sollte an einem kühlen, trockenen Ort, fern von Hitze und unverträglichen Materialien, gelagert werden. Verschüttungen sollten sofort beseitigt werden, um eine Exposition gegenüber dem Stoff zu vermeiden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Einatmen, Verschlucken und Haut-/Augenkontakt vermeiden. Schutzausrüstung tragen. |
| UN-Identifikationsnummern | Nicht reguliert |
| HS-Code | 28321000 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität, kann jedoch bei Einnahme großer Mengen Haut- und Augenreizungen, Atemwegsbeschwerden und Magen-Darm-Beschwerden verursachen. |
Methoden zur Synthese von Calciumbisulfit
Zur Synthese von Ca(HSO3)2 können verschiedene Methoden verwendet werden.
Eine Methode beinhaltet die Reaktion von Schwefeldioxidgas mit Calciumhydroxid , wodurch Ca(HSO3)2 und Wasser entstehen.
Der Prozess beinhaltet die Reaktion von Calciumoxid mit Schwefeldioxidgas, wodurch Calciumsulfit entsteht. Dann entsteht durch die Reaktion von Schwefeldioxidgas mit Calciumsulfit Ca(HSO3)2.
Bei der Reaktion von Schwefeldioxidgas mit Wasser und Calciumcarbonat entstehen Ca(HSO3)2, Kohlendioxidgas und Wasser.
Um Ca(HSO3)2 im Labor zu synthetisieren, kann man einer Lösung aus Calciumhydroxid oder Calciumoxid Schwefeldioxidgas hinzufügen, bis der gewünschte pH-Wert erreicht ist. Die resultierende Lösung enthält Ca(HSO3)2, das durch Filtration oder Fällungsmethoden gereinigt werden kann.
Verwendung von Calciumbisulfit
Aufgrund seiner einzigartigen Eigenschaften findet Ca(HSO3)2 vielfältige Verwendungsmöglichkeiten in verschiedenen Branchen. Hier sind einige der häufigsten Verwendungen von Ca(HSO3)2:
- Lebensmittelindustrie: Wird als Lebensmittelkonservierungsmittel verwendet, um das Wachstum von Bakterien und anderen Mikroorganismen in Lebensmitteln, insbesondere in Obst und Gemüse, zu verhindern.
- Wasseraufbereitung: Wird bei der Wasseraufbereitung verwendet, um überschüssiges Chlor und andere Chemikalien aus dem Wasser zu entfernen und das Wachstum von Bakterien und Algen in Wassersystemen zu verhindern.
- Textilindustrie: Wird in der Textilindustrie verwendet, um überschüssigen Farbstoff aus Stoffen zu entfernen und ein Ausbleichen während des Färbevorgangs zu verhindern.
- Papierindustrie: Wird in der Papierindustrie verwendet, um Zellstoff aufzuhellen und Verfärbungen von Papierprodukten zu verhindern.
- Chemische Industrie: Wird in der chemischen Industrie als Reduktionsmittel und als Quelle für Schwefeldioxidgas verwendet.
- Pharmazeutische Industrie: Wird in der pharmazeutischen Industrie als Antioxidans und Konservierungsmittel in bestimmten Medikamenten verwendet.
Fragen:
F: Genehmigt die Europäische Behörde für Lebensmittelsicherheit Calciumbisulfit?
A: Ja, die Europäische Behörde für Lebensmittelsicherheit (EFSA) hat die Verwendung von Ca(HSO3)2 als Lebensmittelzusatzstoff genehmigt. Es ist in der Europäischen Union als zugelassenes Lebensmittelkonservierungsmittel aufgeführt.
F: Was ist die E-Bewertung von Calciumbisulfit?
A: Die E-Zahl von Ca(HSO3)2 ist E227. Die E-Nummer ist ein von der Europäischen Union für Lebensmittelzusatzstoffe vergebener Code.
F: Ist Calciumbisulfit sicher?
A: Ca(HSO3)2 gilt im Allgemeinen als sicher für den Verzehr in kleinen Mengen. Allerdings kann es bei Einnahme großer Mengen zu Haut- und Augenreizungen, Atemwegsbeschwerden und Magen-Darm-Beschwerden führen. Es ist wichtig, Ca(HSO3)2 ordnungsgemäß zu handhaben und zu lagern, um seine Sicherheit zu gewährleisten.
F: Wie hoch ist die Löslichkeit von Calciumbisulfit in Wasser?
A: Ca(HSO3)2 ist in Wasser mäßig löslich, mit einer Löslichkeit von etwa 60 Gramm pro 100 Milliliter Wasser bei Raumtemperatur.
F: Was sind die thermodynamischen Eigenschaften von Calciumbisulfit?
A: Zu den thermodynamischen Eigenschaften von Ca(HSO3)2 gehören ein Schmelzpunkt von etwa 150 °C und ein Siedepunkt von etwa 160 °C. Auch seine Wärmekapazität und Bildungsenthalpie wurden in verschiedenen Forschungsstudien untersucht.
